
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(夹持装置省略),按要求回答问题:
(1)写出浓盐酸与二氧化锰反应制取Cl2的离子方程式 ,
实验中若用0.2mol浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是 ,
(2)①装置B的作用是;
②装置C和D出现的不同现象说明的问题是;
③装置E的作用是;
(3)乙同学认为甲同学的实验有缺陷,不能确定最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置与之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为 .
A.湿润的淀粉KI试纸 B.氢氧化钠溶液
C.湿润的红色布条 D.饱和的食盐水.
【答案】
(1)MnO2+4H++2Cl﹣(浓) ![]() Mn2++Cl2↑+2H2O,随着反应的进行,盐酸不断被消耗,不断生成水,浓盐酸变成稀盐酸,反应停止
Mn2++Cl2↑+2H2O,随着反应的进行,盐酸不断被消耗,不断生成水,浓盐酸变成稀盐酸,反应停止
(2)检验水蒸气,氯气无漂白性,氯气与水反应生成的HClO具有漂白性,吸收氯气,避免对F产生干扰
(3)E,F,AC
【解析】解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式:MnO2+4H++2Cl﹣(浓) ![]() Mn2++Cl2↑+2H2O;随着反应进行,盐酸不断被消耗,不断生成水,浓盐酸变成稀盐酸,稀盐酸与二氧化锰不反应,所以若用0.2mol浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的;
Mn2++Cl2↑+2H2O;随着反应进行,盐酸不断被消耗,不断生成水,浓盐酸变成稀盐酸,稀盐酸与二氧化锰不反应,所以若用0.2mol浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的;
所以答案是:MnO2+4H++2Cl﹣(浓) ![]() Mn2++Cl2↑+2H2O;随着反应的进行,盐酸不断被消耗,不断生成水,浓盐酸变成稀盐酸,反应停止;(2)①无水硫酸铜与水反应生成蓝色的五水硫酸铜,用无水硫酸铜检验水蒸气的存在;
Mn2++Cl2↑+2H2O;随着反应的进行,盐酸不断被消耗,不断生成水,浓盐酸变成稀盐酸,反应停止;(2)①无水硫酸铜与水反应生成蓝色的五水硫酸铜,用无水硫酸铜检验水蒸气的存在;
所以答案是:检验水蒸气;
②干燥的氯气依次通过干燥的有色布条,湿润的有色布条,干燥布条不褪色,湿润布条褪色,说明氯气不具有漂白性,氯气与水反应生成的HClO具有漂白性;
所以答案是:氯气无漂白性,氯气与水反应生成的HClO具有漂白性;
③氯气与水反应生成盐酸和次氯酸,盐酸能够与硝酸银反应生成白色沉淀,对氯化氢检验造成干扰,所以应用四氯化碳吸收氯气,防止对F产生干扰;
所以答案是:吸收氯气,避免对F产生干扰;(3)F装置用来检验HCl气体,为了确保实验结论的可靠性,应排除氯气的干扰,在E吸收氯气之后要检验氯气是否完全除去,根据氯气具有强氧化性的性质,可用湿润的淀粉KI试纸检验,如不变色,说明已经完全除去,或湿润的有色布条检验,
所以答案是:E;F;AC.
【考点精析】解答此题的关键在于理解氯气的实验室制法的相关知识,掌握实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O.


科目:高中化学 来源: 题型:
【题目】氢气是一种十分熟悉的物质.在许多反应中既可以作为反应物,也可以作物生成物.
(1)电解饱和食盐水制取氢气,反应的化学方程式
(2)在氢气还原氧化铜的反应中,标出电子转移的方向及数目. H2+CuO ![]() Cu+H2O.
Cu+H2O.
(3)在铜锌原电池中,如图,在铜极附近看到的现象是;电子流向从 .
(4)氢气作为燃料,有1g氢气燃烧生成液态水放出142.8kJ热量,表示该反应的热化学方程式;
(5)实验室用锌与稀硫酸反应制取氢气.某学校实验员为了提高制取氢的速度,在此溶液中加入少量硫酸铜溶液,你认为合理吗?为什么? . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.NH4HCO3溶于过量的浓KOH溶液中并加热:NH4++HCO3﹣+2OH﹣=CO32﹣+NH3↑+2H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全:2Al3++3SO42﹣+3Ba2++6OH ﹣=2 Al(OH)3↓+3BaSO4↓
C.向FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl﹣
D.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3﹣═3Fe3++NO↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将装有50mL NO2、NO混合气体的量筒倒立于水槽中,反应后气体体积缩小为30mL,则原混合气体中NO2和NO的体积比是( )
A.5:3
B.3:5
C.3:2
D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5mol的Fe和一定量稀硝酸恰好完全反应生成Fe(NO3)2、Fe(NO3)3和NO,经测定其中Fe(NO3)2与Fe(NO3)3的物质的量之比为3:2,请计算:
(1)生成NO的物质的量;
(2)原稀硝酸中含HNO3的物质的量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要意义.
部分短周期主族元素的最高价氧化物对应水化物(浓度均为0.01molL﹣1)溶液的pH和原子序数的关系如下图所示.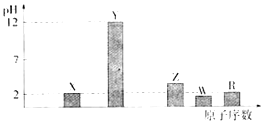
(1)元素R在周期表中的位置是 .
(2)元素Y和W形成的Y2W2型化合物中含有的化学键类型为 .
(3)X的一种氧化物XO2与水反应的化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个2L容密闭容器中充入3.6molN2和10.8molH2 , 一定的条件下反应生成NH3 , 10min后测得N2的浓度是0.8molL﹣1 , 则在这10min内NH3的平均反应速率是( )
A.0.1 molL﹣1min﹣1
B.0.2 molL﹣1min﹣1
C.0.3 molL﹣1min﹣1
D.0.6 molL﹣1min﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com