
【题目】运用元素周期律研究元素及其化合物的性质具有重要意义.
部分短周期主族元素的最高价氧化物对应水化物(浓度均为0.01molL﹣1)溶液的pH和原子序数的关系如下图所示.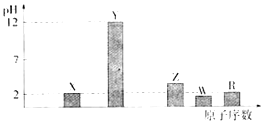
(1)元素R在周期表中的位置是 .
(2)元素Y和W形成的Y2W2型化合物中含有的化学键类型为 .
(3)X的一种氧化物XO2与水反应的化学方程式为: .
【答案】
(1)第三周期第VIIA族
(2)离子键和非极性共价键
(3)3NO2+H2O=2HNO3+NO
【解析】解:元素的金属性越强,其对应最高价氧化物的水化物碱性越强则该溶液的pH越大,元素的非金属性越强,其最高价氧化物的水化物酸性越强则该溶液的pH越小,浓度均为0.01mol.L﹣1 , 根据图象知,最高价氧化物对应的水化物,X、R都为酸且为一元强酸,Y为一元强碱,Z、W为多元酸,对应的原子序数逐渐增大,所以,X、Y、Z、W、R分别为N、Na、P、S、Cl元素.(1)R是Cl元素,主族元素原子核外电子层数与其周期数相等,最外层电子数与其族序数相等,Cl原子核外有3个电子层、最外层电子数是7,所以位于第三周期第VIIA族,所以答案是:第三周期第VIIA族;(2)元素Y和W形成的Y2W2型化合物为Na2S2 , 其电子式为: ![]() ,含有离子键、非极性共价键,所以答案是:离子键、非极性共价键;(3)X的一种氧化物是二氧化氮,二氧化氮和水反应生成硝酸和NO,反应方程式为3NO2+H2O=2HNO3+NO,
,含有离子键、非极性共价键,所以答案是:离子键、非极性共价键;(3)X的一种氧化物是二氧化氮,二氧化氮和水反应生成硝酸和NO,反应方程式为3NO2+H2O=2HNO3+NO,
所以答案是:3NO2+H2O=2HNO3+NO.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(夹持装置省略),按要求回答问题:
(1)写出浓盐酸与二氧化锰反应制取Cl2的离子方程式 ,
实验中若用0.2mol浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是 ,
(2)①装置B的作用是;
②装置C和D出现的不同现象说明的问题是;
③装置E的作用是;
(3)乙同学认为甲同学的实验有缺陷,不能确定最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置与之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为 .
A.湿润的淀粉KI试纸 B.氢氧化钠溶液
C.湿润的红色布条 D.饱和的食盐水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是 ( )
A. 摩尔质量的常用单位为g·mol-1
B. 阿伏加德罗常数约为6.02×1023 mol-1
C. 二氧化硫的摩尔质量为64 g·mol-1
D. 摩尔质量就是相对原子质量的6.02×1023倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D.已知D为强酸,请回答下列问题:A ![]() B
B ![]() C
C ![]() D,若A在常温下为气体,C是红棕色的气体.
D,若A在常温下为气体,C是红棕色的气体.
(1)、 A,C的化学式分别是:A、C .
(2)、D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式;该反应(填“属于”或“不属于”)氧化还原反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | NaHSO4溶液与Ba(OH)2溶液反应至 | 正确 |
B | 向碳酸镁溶液中加入足量稀盐酸: | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O=Fe(OH)3↓+3H+ | 正确 |
D | NaOH溶液中通入少量CO2反应:OH+CO2= | 正确 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.1g镁铝合金的碎片加入50mL盐酸中,待合金完全溶解后,生成0.1mol H2 , 得到溶液X.下列分析一定正确的是( )
A.开始时观察到金属碎片表面有极少量气泡,可能原因为该金属片表面有氧化膜
B.过程中观察到金属碎片表面有大量气泡并在液面上“翻滚”,说明该合金碎片的密度小于该盐酸溶液的密度
C.该盐酸的物质的量浓度一定为4.0 molL﹣1
D.溶液X中Mg2+与Al3+的物质的量之比一定为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com