
【题目】下列叙述中不正确的是 ( )
A. 摩尔质量的常用单位为g·mol-1
B. 阿伏加德罗常数约为6.02×1023 mol-1
C. 二氧化硫的摩尔质量为64 g·mol-1
D. 摩尔质量就是相对原子质量的6.02×1023倍
科目:高中化学 来源: 题型:
【题目】X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( ) 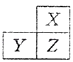
A.原子半径:Y>Z>X
B.气态氢化物的热稳定性:X<Z
C.y和z的最高价氧化物对应水化物均为强酸
D.若z的最高正价为+m,则X的最高正价也一定为+m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将装有50mL NO2、NO混合气体的量筒倒立于水槽中,反应后气体体积缩小为30mL,则原混合气体中NO2和NO的体积比是( )
A.5:3
B.3:5
C.3:2
D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5mol的Fe和一定量稀硝酸恰好完全反应生成Fe(NO3)2、Fe(NO3)3和NO,经测定其中Fe(NO3)2与Fe(NO3)3的物质的量之比为3:2,请计算:
(1)生成NO的物质的量;
(2)原稀硝酸中含HNO3的物质的量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要意义.
部分短周期主族元素的最高价氧化物对应水化物(浓度均为0.01molL﹣1)溶液的pH和原子序数的关系如下图所示.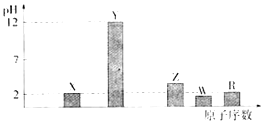
(1)元素R在周期表中的位置是 .
(2)元素Y和W形成的Y2W2型化合物中含有的化学键类型为 .
(3)X的一种氧化物XO2与水反应的化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意进行计算:
(1)向200mL0.5mol/LAl2(SO4)3溶液中,加入350mL2mol/L NaOH溶液,充分反应后可以得到Al(OH)3沉淀多少g?
(2)若想得到3.9g Al(OH)3沉淀,应向200mL0.5mol/LAl2(SO4)3溶液中加入2mol/L NaOH溶液多少mL?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10﹣10 , Ksp(AgBr)=7.7×10﹣13 , Ksp(Ag2CrO4)=9.0×10﹣12 . 某溶液中含有Cl﹣、Br﹣和CrO42﹣浓度均为0.010molL﹣1 , 向该溶液中逐滴加入0.010molL﹣1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl﹣、Br﹣、CrO42﹣
B.CrO42﹣、Br﹣、Cl﹣
C.Br﹣、Cl﹣、CrO42﹣
D.Br﹣、CrO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质中是同系物的有________;互为同分异构体的有________;互为同素异形体的有________;互为同位素的有________;互为同一物质的有________; (1)液氯 (2)氯气 (3)白磷 (4)红磷 (5)氕 (6)氚 (7) ![]() (8)
(8) ![]() (9)CH2=CH﹣CH3 (10)
(9)CH2=CH﹣CH3 (10) ![]() (11)2,2﹣二甲基丁烷.
(11)2,2﹣二甲基丁烷.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com