
【题目】X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( ) 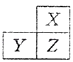
A.原子半径:Y>Z>X
B.气态氢化物的热稳定性:X<Z
C.y和z的最高价氧化物对应水化物均为强酸
D.若z的最高正价为+m,则X的最高正价也一定为+m
【答案】A
【解析】解:X、Y、Z是三种短周期的主族元素,由各元素在周期表中的位置可知,X处于第二周期,Y、Z处于第三周期.X原子的最外层电子数是其次外层电子数的3倍,则X最外层电子数为6,故X为氧元素,Z为硫元素,Y为磷元素.A、同周期随原子序数增大,原子半径减小,所以原子半Y>Z,同主族自上而下,原子半径增大,所以原子半径Z>X,故原子半径Y>Z>X,故A正确;
B、同主族自上而下,非金属性减弱,所以非金属性X>Z,非金属性越强,氢化物越稳定,所以气态氢化物的热稳定性X>Z,故B错误;
C、硫酸是强酸,磷酸属于中强酸,故C错误;
D、硫元素的最高正价为+6价,氧元素一般没有正化合价,故D错误.
故选:A.
X、Y、Z是三种短周期的主族元素,由各元素在周期表中的位置可知,X处于第二周期,Y、Z处于第三周期.X原子的最外层电子数是其次外层电子数的3倍,则X最外层电子数为6,故X为氧元素,Z为硫元素,Y为磷元素.结合元素周期律进行解答.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】w g铁粉和铝粉的混合物,和过量的NaOH反应,然后过滤,将沉淀完全收集后,放蒸发皿中加热,直至被加热的物质质量不再变化,取出蒸发皿中的物质称量仍为w g.求原混合物中铝粉的质量分数是( )
A.30%
B.50%
C.70%
D.90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,第一种是含氧酸,第二种是混合物,第三种是碱的是( )
A. 爆鸣气、硫酸铜、硫酸 B. 水、空气、纯碱
C. 硝酸、石灰石、烧碱 D. 氧化铁、胆矾、熟石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是( )
A.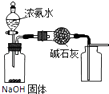
用如图装置制取干燥纯净的NH3
B.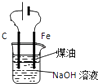
用如图装置制备Fe(OH)2并能较长时间观察其颜色
C.
用如图装置可以完成“喷泉”实验
D.
用如图装置测量Cu与浓硝酸反应产生气体的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.原电池外电路中电子由负极流向正极
B.原电池中发生还原反应的电极是正极
C.电解池中发生还原反应的电极是阳极
D.电解池中质量增加的电极是阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO.反应如下: Ca3(PO4)2+SiO2+C ![]() CaSiO3+P4↑+CO↑
CaSiO3+P4↑+CO↑
(1)配平该反应方程式,并标出电子转移方向和数目. Ca3(PO4)2+SiO2+C ![]() CaSiO3+P4↑+CO↑
CaSiO3+P4↑+CO↑
(2)该反应中被还原的元素是 , 氧化产物是 .
(3)每消耗24.0g碳时,有个电子发生转移,生成P4g.
(4)反应所得混合气体,折算成标况下,其气体密度为g/L(保留两位小数).与该反应中涉及到的磷元素相同主族的氮元素,是造成水体富营养化的主要原因.若某污水中NH4Cl含量为180mg/L.
(5)写出NH4Cl的电子式 .
(6)为除去废水中的NH4+ , 向103L该污水中加入0.1mol/LNaOH溶液,发生如下反应:NH4++OH﹣→NH3+H2O.则理论上需要NaOH溶液的体积为L(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是 ( )
A. 摩尔质量的常用单位为g·mol-1
B. 阿伏加德罗常数约为6.02×1023 mol-1
C. 二氧化硫的摩尔质量为64 g·mol-1
D. 摩尔质量就是相对原子质量的6.02×1023倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com