
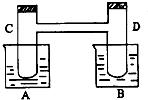
 如图所示,在烧杯A中盛有20℃,50毫升水,B中盛有1摩/升盐酸50毫升,试管C、D相通,其中盛有红棕色气体,它处于下列平衡状态,2NO2?N2O4(△H<0,放热).当向A中加入50克硝酸铵使其溶解,往B中加入2克苛性钠,也使其溶解时,问:(注:硝酸铵溶于水吸热)
如图所示,在烧杯A中盛有20℃,50毫升水,B中盛有1摩/升盐酸50毫升,试管C、D相通,其中盛有红棕色气体,它处于下列平衡状态,2NO2?N2O4(△H<0,放热).当向A中加入50克硝酸铵使其溶解,往B中加入2克苛性钠,也使其溶解时,问:(注:硝酸铵溶于水吸热)分析 (1)A中加入50克硝酸铵使其溶解,硝酸铵溶于水吸热,溶液温度降低,往B中加入2克苛性钠,使其溶解,溶液温度升高;
(2)硝酸铵溶于水吸热,溶液温度降低,平衡向放热反应方向进行,苛性钠溶解溶液温度升高,平衡向吸热反应方向进行;
(3)在烧杯A中盛有20℃,50毫升水近似为50g水,溶解度是指100g水溶解溶质达到饱和时溶解溶质的质量,据此计算;
(4)由于存在平衡2NO2(g)?N2O4(g),N2O4的存在会影响二氧化氮的相对分子质量测定,故应采取措施使平衡向左移动,减小N2O4的含量,根据温度、压强对平衡的影响判断.
解答 解:(1)硝酸铵溶于水吸热,溶液温度降低,苛性钠溶解过程中溶液温度升高,
故答案为:降低;升高;
(2)2NO2?N2O4(△H<0,放热),硝酸铵溶于水吸热,溶液温度降低,平衡向放热反应方向进行,平衡正向进行混合气体颜色变浅,苛性钠溶解溶液温度升高,平衡向吸热反应方向进行,平衡逆向进行,混合气体颜色变深,
故答案为:浅;深;
(3)溶解度是指100g水溶解溶质达到饱和时溶解溶质的质量,在20℃时,硝酸铵的溶解度为197克,100g水中溶解197g硝酸铵达到饱和,在烧杯A中盛有20℃,50毫升水近似为50g水,加入50克硝酸铵,溶液未达到平衡状态,
故答案为:未;
(4)由于存在平衡2NO2(g)?N2O4(g),N2O4的存在会影响二氧化氮的相对分子质量测定,故应采取措施使平衡向左移动,减小N2O4的含量,该反应正反应是体积减小的放热反应,减小压强平衡向逆反应移动,升高温度平衡向逆反应移动,故应采取高温低压,故选C,
故答案为:C.
点评 本题考查了好像平衡影响因素、平衡移动过程中混合气体颜色变化、物质性质等知识点,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 | (不写) | Zn+Fe2+═Zn2++Fe | |
| ③ | 在FeCl3溶液中加入足量铁粉 | Fe+2Fe3+═3Fe2+ | Fe3+具有氧化性 | |
| ④ | (不写) | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
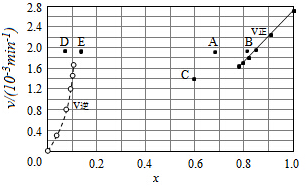 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
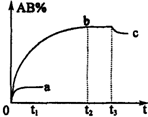 反应A2+B2?2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况.则下列叙述正确的是( )
反应A2+B2?2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况.则下列叙述正确的是( )| A. | A2、B2及AB均为气体,Q>0 | |
| B. | AB为气体,A2、B2中至少有一种为非气体,Q<0 | |
| C. | AB为气体,A2、B2中有一种为气体,Q<0 | |
| D. | AB为固体,A2、B2中有一种为非气体,Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠 食盐 NaCl2 | B. | 碳酸氢钠 纯碱 NaHCO3 | ||
| C. | 氢氧化钠 烧碱 NaOH | D. | 氢氧化钙 熟石灰 CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦ | B. | ②③⑤ | C. | ①②④⑥⑦ | D. | ①②③④⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com