
【题目】见下图(A)处通入Cl2,当关闭(B)阀时,(C)处的湿润的红布条没有明显变化,当打开(B)阀时,(C)处的湿润红布条逐渐褪色,则(D)瓶中装的溶液是

A. 浓硫酸B. NaOH溶液C. 水D. NaCl溶液
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 风能、太阳能等属于一次能源
B. X![]() Y+Z正反应吸热,则逆反应必然放热
Y+Z正反应吸热,则逆反应必然放热
C. 化学反应的焓变ΔH越大,表示放热越多
D. 稀溶液中,酸碱中和反应生成1 mol H2O时放热不一定为57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向分别含SO32-、Fe2+、Br-、I-各0.1mol的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系图正确的是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是( )
A.  若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
B.  表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
C.  表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
D.  表示25℃时,向0.1 molL﹣1的NH4Cl溶液中滴加0.1 molL﹣1的盐酸,溶液中c(H+)/c(NH4+)随盐酸体积的变化关系
表示25℃时,向0.1 molL﹣1的NH4Cl溶液中滴加0.1 molL﹣1的盐酸,溶液中c(H+)/c(NH4+)随盐酸体积的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行的反应:N2 + 3H22NH3,下列说法正确的是
A. 降低温度能加快逆反应速率
B. 保持体积不变充入N2,能加快反应速率
C. 达到平衡时,反应速率:v(正) =v(逆)=0
D. 达到平衡时,N2和H2的转化率可能达到100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定金属镁的相对原子质量,请利用如图给定的仪器组成一套实验装置(每个仪器只能使用一次,假设气体的体积可看作标准状况下的体积)。

填写下列各项(气流从左到右):
(1)各种仪器连接的先后顺序是___接___、___接___、___接___、_____接___(用小写字母表示)。
(2)连接好仪器后,要进行的操作有以下几步,其先后顺序是____(填序号)。
①待仪器B中的温度恢复至室温时,测得量筒C中水的体积为V0 mL;
②擦掉镁条表面的氧化膜,将其置于天平上称量,得质量为w g,并将其投入试管B中的带孔隔板上;
③检查装置的气密性;
④旋开装置A上分液漏斗的活塞,使其水顺利流下,当镁完全溶解时再关闭这个活塞,这时A中共放入水V1mL。
(3)根据实验数据可算出金属镁的相对原子质量,其数学表达式为____。
(4)若试管B的温度未冷却至室温,就读出量筒C中水的体积,这将会使所测定镁的相对原子质量数据____(填“偏大”“偏小”或“无影响”)。
(5)仔细分析上述实验装置后,经讨论认为结果会有误差,于是又设计了如图所示的实验装置。
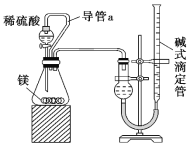
装置中导管a的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是
A. 离子化合物中不可能含有共价键 B. 晶体中一定存在化学键
C. 碱性氧化物一定是金属氧化物 D. 直径介于1~10 nm之间的微粒称为胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) ![]() N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) ![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) ![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com