
【题目】H2C2O4(草酸)为二元弱酸,在水溶液中H2C2O4、HC2O4-和C2O42-物质的量分数与pH关系如图所示,下列说法不正确的是
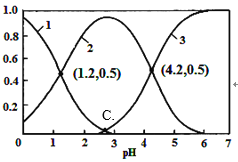
A. 由图可知,草酸的Ka=10-1.2
B. 0.1 mol·L—1NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(OH-)
C. 向草酸溶液中滴加氢氧化钠溶液至pH为4.2时c(Na+)+c(H+)=3c(C2 O42-)+c(OH-)
D. 根据图中数据计算可得C点溶液pH为2.8
【答案】D
【解析】
由图线1为H2C2O4、2为HC2O4-、3为C2O42-。
A. 当pH为1.2时c(H+)=10-1.2 mol·L-1,c(HC2O4-)= c(H2C2O4)=0.5 mol·L-1,草酸的Ka=10-1.2,故A正确;
B. 0.1 mol·L-1NaHC2O4溶液显酸性c(H+)>c(OH-),HC2O4-会发生水解和电离c(Na+)>c(HC2O4-),因此c(Na+)>c(HC2O4-)>c(H+)>c(OH-),故B正确;
C. pH为4.2时,溶液中含有微粒为HC2O4-和C2O42-,且c(HC2O4-)= c(HC2O4-),根据电荷守恒 c(Na+)+c(H+)=c(HC2O4-)+2c(C2 O42-)+c(OH-),则有c(Na+)+c(H+)=3c(C2 O42-)+c(OH-),故C正确;
D.由于草酸为弱酸分两步电离,Ka1=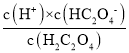 ,Ka2=
,Ka2=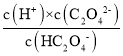 ,Ka1·Ka2=
,Ka1·Ka2=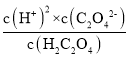 ,根据图中C点得到c(C2O42-)= c(H2C2O4),所以,Ka1
,根据图中C点得到c(C2O42-)= c(H2C2O4),所以,Ka1![]() Ka2=
Ka2=![]() ,当pH为1.2时c(H+)=10-1.2 mol·L-1,c(HC2O4-)= c(H2C2O4)=0.5 mol·L-1,草酸的Ka1=10-1.2。当pH为4.2时c(H+)=10-4.2 mol·L-1,c(HC2O4-)= c(C2O42-)=0.5 mol·L-1,草酸的Ka2=10-4.2;
,当pH为1.2时c(H+)=10-1.2 mol·L-1,c(HC2O4-)= c(H2C2O4)=0.5 mol·L-1,草酸的Ka1=10-1.2。当pH为4.2时c(H+)=10-4.2 mol·L-1,c(HC2O4-)= c(C2O42-)=0.5 mol·L-1,草酸的Ka2=10-4.2;![]() =
=![]() =
=![]() =
=![]() =10-2.7,C点溶液pH为2.7。故D错误。
=10-2.7,C点溶液pH为2.7。故D错误。
答案选D。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】下图装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池。

装置(Ⅰ)的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为2Na2S2+NaBr3化气![]() Na2S4+3NaBr。当闭合开关K时,X电极附近溶液变红。下列说法正确的是
Na2S4+3NaBr。当闭合开关K时,X电极附近溶液变红。下列说法正确的是
A. 闭合开关K时,钠离子从右到左通过离子交换膜
B. 闭合开关K时,负极反应式为:3NaBr-2e-=NaBr3+2Na+
C. 闭合开关K时,X电极反应式为:2Cl--2e-=Cl2↑
D. 闭合开关K时,当有0.1molNa+通过离子交换膜,X电极上析出标准状况下气体1.12L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为________;
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有______(填“氧化性”、“还原性”或“酸性”);②请配平该反应的离子方程式:_____MnO4-+____H2C2O4+___H+=___Mn2++____CO2↑+_____H2O
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
①上述装置中,D的作用是_________,
②乙二酸分解的化学方程式为 ________;
(4)该小组同学将2.52g草酸晶体(H2C2O42H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_______(用文字简单表述),该溶液中各离子的浓度由大到小的顺序为:_______(用离子符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将浓度都是0.1mol·L-1的X2、Y2两种气体充入至密闭容器中,使之发生反应生成气体Z,达到平衡时c(X2)=0.04mol·L-1、c(Y2)=0.08mol·L-1、c(Z)=0.04mol·L-1,则该反应的反应式是
A. X2+2Y2![]() XY2 B. 3X2+Y2
XY2 B. 3X2+Y2![]() 2X3Y
2X3Y
C. 2X2+Y2![]() 2X2Y D. X2+3Y2
2X2Y D. X2+3Y2![]() 2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100molL﹣1的NaOH溶液分别滴定体积和浓度均为20.00mL 0.100molL﹣1的盐酸和醋酸滴定曲线如图所示。下列说法错误的是( )

A. a表示的是醋酸的滴定曲线
B. 滴定b过程中,指示剂可以是酚酞
C. pH=7时,滴定盐酸消耗的V(NaOH)=20.00mL
D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1molL﹣1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A.在0﹣a范围内,只发生中和反应
B.ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O
C.a=0.3
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用如图装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。

操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中所进行反应的离子方程式为_____
(2)图中饱和食盐水的作用是_____
(3)图中盛NaOH溶液的瓶中反应的离子方程式为_____
(4)若用如图装置收集多余的氯气,请在虚线框内画出该装置简图_____

(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。(已知:Na2SO3溶液显碱性,Na2SO4溶液显中性)
提出猜想:
Ⅰ.NaClO把Na2SO3氧化成Na2SO4
Ⅱ.NaClO把酚酞氧化了
Ⅲ.NaClO把Na2SO3和酚酞都氧化了
①下列实验方案中,要证明NaClO氧化了Na2SO3的最佳实验方案是_____
a.向混合后的溶液中加入过量氯化钡溶液
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入氯化钡溶液
d.向混合后的溶液中加入氢氧化钡溶液,过滤后,在沉淀中加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷催化裂化时碳链按两种方式断裂,生成两种烷烃和两种烯烃。如果丁烷的裂化率为60%,且裂化生成的两种烯烃物质的量相等,则裂化后得到的含氢质量分数最高的气体占混合气体的体积分数为
A. 18.75% B. 30% C. 15% D. 22.5%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com