
| A、Na+、Cu2+、CO32-、Cl- |
| B、HCO3-、Cl-、Na+、Mg2+ |
| C、Cl-、NO3-、K+、Ca2+ |
| D、SO42-、H+、K+、NH4+ |
科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、3:3:2 |
| C、2:2:3 |
| D、5:5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0 | B、14 | C、15 | D、1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液 | KOH | HNO3 | CH3COOH | HCl |
| 溶质质量分数ω(%) | 56 | 63 | 60 | 36.5 |
| 物质的量浓度c(mol/L) | 14.3 | 13.8 | 10.6 | 11.8 |
| A、HCl |
| B、HNO3 |
| C、CH3COOH |
| D、KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.56×10-3g |
| B、1.56×10-2g |
| C、7.8×10-4g |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸与Na2SiO3溶液混合:SiO32-+2H+═H2SiO3↓ | ||||
| B、往澄清石灰水中通入过量SO2:SO2+Ca2++2OH-═CaSO3↓+H2O | ||||
| C、NO2通入水中:H2O+3NO2═2H++2NO3-+NO | ||||
D、浓盐酸和二氧化锰共热制取Cl2:MnO2+4H++2Cl-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
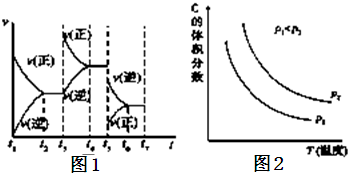
| 高温、高压 |
| 催化剂 |
| 物质 | N2 | H2 | NH3 |
| 起始(mol) | 2 | 7 | 0 |
| 10s(mol) | 1.6 | ||
| 平衡时(mol) | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com