
【题目】部分果蔬中含有下列成分:
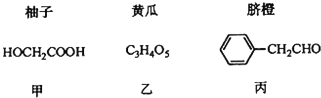
已知:①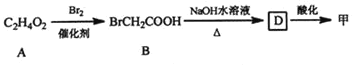
C2H4O2![]() BrCH2COOH
BrCH2COOH![]() D
D![]() 甲
甲
②1mol乙消耗NaHCO3的物质的量是甲的2倍
③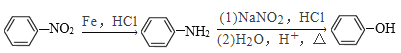
回答下列问题:
(1)甲可由已知①得到。
①甲中含有不饱和键的官能团名称为______。
②A→B为取代反应,A的结构简式为______。
③B→D的化学方程式为______。
(2)乙在一定条件下生成链状酯类有机高分子化合物的化学方程式为______。
(3)由丙经下列途径可得一种重要的医药和香料中间体J(部分反应条件略去):

①用化学方法除去E中残留的少量丙(室温时E和丙呈液态,忽略它们在水中的溶解),第1步加入试剂的名称为______ ,第2、3操作分别是过滤、分液。
②经E→G→H保护的官能团是______,可以表征有机化合物中存在何种官能团的仪器是______。
③J的同分异构体中在核磁共振氢谱上显示为两组峰,峰面积比为3:2的链状且不存在支链的异构体共有______ 种(不含立体异构),其中某异构体L中的官能团都能与H2发生加成反应,则L的结构简式为______ (只写一种)。
【答案】羧基 CH3COOH BrCH2COOH+2NaOH![]() HOCH2COONa+NaBr+H2O nHOOCCH(OH)COOH
HOCH2COONa+NaBr+H2O nHOOCCH(OH)COOH![]()
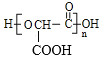 +(n-1) H2O 新制氢氧化铜悬浊液或银氨溶液 羟基 红外光谱仪 8 CH3CH2COC≡CCOCH2CH3,CH3COCH2C≡CCH2COCH3
+(n-1) H2O 新制氢氧化铜悬浊液或银氨溶液 羟基 红外光谱仪 8 CH3CH2COC≡CCOCH2CH3,CH3COCH2C≡CCH2COCH3
【解析】
(1)甲可由已知①得到,根据A的分子式、B的结构可知,A与溴发生取代反应生成B,则A为CH3COOH,B在碱性条件下发生水解反应、中和反应得到D为HOCH2COONa,D酸化得到甲为HOCH2COOH;
(2)1mol乙消耗NaHCO3的物质的量是甲的2倍,则乙分子中含有2个羧基-COOH,乙在一定条件下生成链状酯类有机高分子化合物,则乙中含有2个羧基-COOH和一个羟基-OH,乙为HOOCCH(OH)COOH,反应得到的高分子化合物为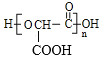 ;
;
(3)丙与H2反应产生E,根据E的结构可知化合物丙是![]() ,丙与H2发生加成反应生成E是
,丙与H2发生加成反应生成E是![]() ,E经过硝化反应、酯化反应得到G,G发生信息③中转化得到H为
,E经过硝化反应、酯化反应得到G,G发生信息③中转化得到H为![]() ,J为
,J为![]() 。
。
(1)由甲可由已知①得到,根据A的分子式、B的结构可知,A与溴发生取代反应生成B,则A为CH3COOH,B在碱性条件下发生水解反应、中和反应得到D为HOCH2COONa,D酸化得到甲是HOCH2COOH,
①甲中含有不饱和键的官能团名称为羧基;
②A的结构简式为:CH3COOH,A与Br2在催化剂存在的条件下发生甲基上的取代反应产生B是BrCH2COOH,所以A→B为取代反应;
③B是BrCH2COOH,与NaOH水溶液混合加热,发生Br原子的取代反应及-COOH与NaOH的中和反应,所以B→D的化学方程式为:BrCH2COOH+2NaOH![]() HOCH2COONa+NaBr+H2O;
HOCH2COONa+NaBr+H2O;
(2)1mol乙消耗NaHCO3的物质的量是甲的2倍,则乙分子中含有2个羧基,乙在一定条件下生成链状酯类有机高分子化合物,则乙为HOOCCH(OH)COOH,乙发生反应得到的高分子化合物为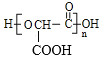 ,反应方程式为:nHOOCCH(OH)COOH
,反应方程式为:nHOOCCH(OH)COOH![]()
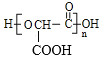 +(n-1) H2O;
+(n-1) H2O;
(3)![]() 与H2发生加成反应生成E为
与H2发生加成反应生成E为![]() ,E经过硝化反应、酯化反应得到G,G发生信息③中转化得到H为
,E经过硝化反应、酯化反应得到G,G发生信息③中转化得到H为![]() ,J为
,J为![]() 。
。
①用化学方法除去E中残留的少量丙,第1步加入试剂的名称为新制氢氧化铜或银氨溶液,将残留的少量丙氧化成易溶于水的苯乙酸盐,第2、3步操作分别是过滤、分液;
②经E→G→H保护的官能团是羟基,可以表征有机化合物中存在何种官能团的仪器是红外光谱仪;
③J(![]() )的同分异构体中,在核磁共振氢谱上显示为两组峰,峰面积比为3:2的链状且不存在支链的异构体,分子中含有2个-CH3、2个-CH2-,且为对称结构,可能的结构简式为:CH3CH2COC≡CCOCH2CH3,CH3COCH2C≡CCH2COCH3,CH3CH2OC≡C-C≡COCH2CH3,CH3OCH2C≡C-C≡CCH2OCH3,CH3OC≡CCH2-CH2C≡COCH3,CH3C≡COCH2-CH2OC≡CCH3,CH3C≡CCH2OOCH2C≡CCH3,CH3CH2C≡COOC≡CCH2CH3,共有8种,其中某种异构体L中的官能团都能与H2发生加成反应,则L的结构简式为 CH3CH2COC≡CCOCH2CH3,CH3COCH2C≡CCH2COCH3。
)的同分异构体中,在核磁共振氢谱上显示为两组峰,峰面积比为3:2的链状且不存在支链的异构体,分子中含有2个-CH3、2个-CH2-,且为对称结构,可能的结构简式为:CH3CH2COC≡CCOCH2CH3,CH3COCH2C≡CCH2COCH3,CH3CH2OC≡C-C≡COCH2CH3,CH3OCH2C≡C-C≡CCH2OCH3,CH3OC≡CCH2-CH2C≡COCH3,CH3C≡COCH2-CH2OC≡CCH3,CH3C≡CCH2OOCH2C≡CCH3,CH3CH2C≡COOC≡CCH2CH3,共有8种,其中某种异构体L中的官能团都能与H2发生加成反应,则L的结构简式为 CH3CH2COC≡CCOCH2CH3,CH3COCH2C≡CCH2COCH3。


科目:高中化学 来源: 题型:
【题目】α,β,γ和δ4种生育三烯酚(见下图)是构成维生素E的主要物质,下列叙述中不正确的是( )
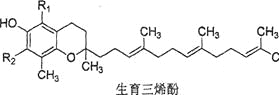
α β γ δ | |
R1 | CH3 CH3 H H |
R2 | CH3 H CH3 H |
A.α和β两种生育三烯酚互为同系物,β和γ两种生育三烯酚互为同分异构体
B.4种生育三烯酚均可使酸性高锰酸钾溶液褪色
C.4种生育三烯酚都难溶于水
D.1molδ生育三烯酚与溴水发生反应,理论上最多可消耗3molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
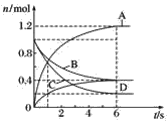
A.该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一切植物中均含有天然有机高分子化合物A,它是构成植物细胞壁的基础物质,不溶于水,也不溶于一般的有机溶剂。各物质之间的转化关系如下所示(A~F均分别代表一种物质,部分产物略去):
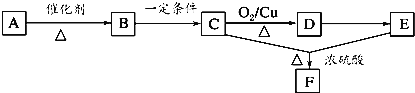
已知:B生成C的同时还有CO2生成,请回答下列问题:
(1)由A生成B的化学方程式为 ______。
(2)B、C均含有的官能团名称是 ______。
(3)A→F发生反应的反应类型有 ______(填序号)。
A.氧化反应 B.酯化反应 C.加成反应 D.水解反应
(4)写出C→D所发生反应的化学方程式:______。
(5)F有多种同分异构体,请写出与它具有相同官能团且能发生银镜反应的所有同分异构体 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.过氧化钠的电子式是 Na+[:O:O:]2-Na+
B.原子最外层电子排布式为4s1和5s1 是同一主族元素
C.电负性差值大于 1.7 的化合物一定是离子化合物
D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是H2O,配位数是 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某大型化工生产的工艺流程图![]() 部分反应物或生成物已经略去
部分反应物或生成物已经略去![]() :
:
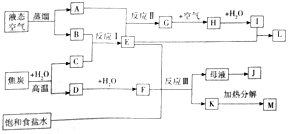
请回答下列问题:
![]() 流程中所涉及的化学工业有:合成氨、 ______ 联合制碱法
流程中所涉及的化学工业有:合成氨、 ______ 联合制碱法![]() 或侯式制碱法
或侯式制碱法![]() .
.
![]() 工业从液态空气中分离出A、B利用的原理是 ______ .
工业从液态空气中分离出A、B利用的原理是 ______ .
![]() 图示中G生成H的流程中为了提高原料的利用率和减少污染,生产中往往采取的操作是 ______ .
图示中G生成H的流程中为了提高原料的利用率和减少污染,生产中往往采取的操作是 ______ .
![]() 工业生产反应Ⅰ的方程式为 ______ ,为提高原料转化率的反应条件是 ______ ,生产中需将产物液化分离的目的是 ______ .
工业生产反应Ⅰ的方程式为 ______ ,为提高原料转化率的反应条件是 ______ ,生产中需将产物液化分离的目的是 ______ .
![]() 写出反应Ⅱ的化学方程式 ______ .
写出反应Ⅱ的化学方程式 ______ .
![]() 图示中生成小苏打的化学方程式 ______ ,母液与K分离的方法是 ______
图示中生成小苏打的化学方程式 ______ ,母液与K分离的方法是 ______ ![]() 有两种方案从母液中获得副产品J:
有两种方案从母液中获得副产品J:![]() 通入氨气、冷却、加食盐、过滤
通入氨气、冷却、加食盐、过滤![]() 不通氨气、冷却、加食盐、过滤对比这两种方案.方案
不通氨气、冷却、加食盐、过滤对比这两种方案.方案![]() 通入氨气的作用 ______ ;方案
通入氨气的作用 ______ ;方案![]() 滤液一般不能反复循环利用,其原因是 ______ .
滤液一般不能反复循环利用,其原因是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。
(1)甲小组设计了如下图所示的实验装置(固定装置已略去)。

①若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_______(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是___________________;装置D的作用是___________________。
③装置C中发生反应的化学方程式为________________________________。
④若A、B中药品足量,则可以观察到装置F中的实验现象是_____________________________。
⑤该装置存在的主要缺陷是___________________________________________________。
(2)乙小组认为可将甲小组的装置中A、B部分换成如图所示装置(其余部分相同)进行实验。

①烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是___________,U型管中加入的试剂是___________。
②此装置能产生大量氨气的原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素 X、Y、Z、W 的相对位置如表,元素 X 的原子核外电子数是 Z的 2 倍。下列说法不正确的是
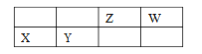
A. W 元素的简单气态氢化物的热稳定性比 Z 元素的简 单气态氢化物的高
B. 气体分子(ZW)2 的结构式为 N≡C—C≡N
C. X、Y、W 三种元素的简单离子半径最大的是 Y
D. 元素 X 位于周期表中第三周期、第ⅡA族,其单质制备可用电解熔融 XCl2 的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是
A.如图中测定锌粒与l mol/L稀硫酸的反应速率,只需测定注射器中收集氢气的体积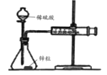
B.如图装置中进行50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液发生中和反应放出热量的测定,使温度计温度升高的热量就是中和反应生成1 mol水的热量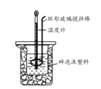
C.如图酸碱中和滴定中,可以在滴定过程中用少量水冲洗锥形瓶内壁
D.如图滴定管中液面位置如图所示,则此时的读数为23.65 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com