
【题目】下列说法中正确的是( )
A.过氧化钠的电子式是 Na+[:O:O:]2-Na+
B.原子最外层电子排布式为4s1和5s1 是同一主族元素
C.电负性差值大于 1.7 的化合物一定是离子化合物
D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是H2O,配位数是 4
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】铁及其化合物用途非常广泛。
(1)已知赤铁矿还原冶炼时是逐级进行的,已知:
(a) 3Fe2O3(s)+CO(g) ![]() 2Fe3O4(s)+CO2(g)
2Fe3O4(s)+CO2(g) ![]() H = a kJ·mol-1
H = a kJ·mol-1
(b) Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g) ![]() H =b kJ·mol-1
H =b kJ·mol-1
(c) Fe3O4(s)+CO(g) ![]() 3FeO(s)+CO2 (g)
3FeO(s)+CO2 (g) ![]() H = c kJ·mol-1
H = c kJ·mol-1
①上述反应(a)平衡常数表达式为K=___________________。
②反应FeO(s)+CO(g) ![]() Fe(s)+CO2(g)
Fe(s)+CO2(g) ![]() H =__________kJ·mol-1(用含a、b、c的代数式表示)。
H =__________kJ·mol-1(用含a、b、c的代数式表示)。
(2)用类似冶炼铝的方法, 在600~1000℃时电解熔融的Fe2O3冶炼铁(装置示意图如图),该法除消耗能量较少外,另一最突出的优点是__________________________________;电解时阳极发生的电极反应为____________。
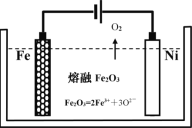
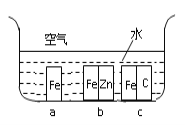
(3)生铁在自然界中可发生析氢腐蚀和吸氧腐蚀,析氢腐蚀的负极的电极反应式为_________;如图所示,纯铁处于a、b、c三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填字母)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下:
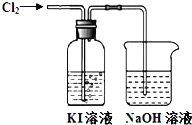
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)Cl2与NaOH溶液反应的化学方程式是___。
(2)KI溶液变为黄色说明氯气具有的___性,该反应的离子方程式是___。
(3)已知I2+I-![]() I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
①实验b的目的是___。
②根据实验a中,水层中含有的粒子有___。
操作 | 实验现象 | |
a | 取2~3mL黄色溶液,加入足量CCl4,振荡静置 | CCl4层呈紫红色,水层显浅黄色 |
b | 取2~3mL饱和碘水,加入足量CCl4,振荡静置 | CCl4层呈紫红色,水层几近无色 |
③实验a中水溶液颜色变浅的原因是___。
④为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为___。
(4)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化,已知1molCl2可氧化0.2molI2,该反应的化学方程式是___。
(5)根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为___。
(6)溶液最终变为浅绿色的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素类化合物具有芳香气味,是生药中的一类重要的活性成分,主要分布在伞形科、豆科、菊科、芸香科、茄科、瑞香科、兰科等植物中。化合物X是一种香豆素衍生物,可以用作香料,其合成路线如下:
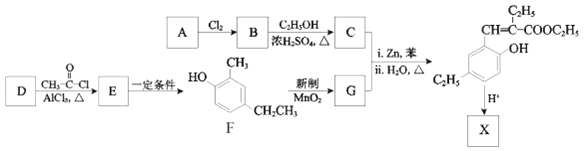
已知:
①RCHO+R’CH2Cl![]() RCH=CHR’
RCH=CHR’
②![]()
![]()
![]()
![]()
![]()
③![]()
(1)已知A的分子式为C4H8O2,A所含官能团的名称是______。
(2)B生成C反应的化学方程式是______。
(3)G的结构简式是______。
(4)D的分子式是C7H8O,与F互为同系物。则D的结构简式是______。
(5)E可以经多步反应合成F,请写出一条可能的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件) ______。
(6)X的分子式是C13H14O2,X与足量NaOH溶液共热的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分果蔬中含有下列成分:
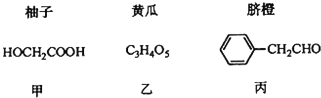
已知:①
C2H4O2![]() BrCH2COOH
BrCH2COOH![]() D
D![]() 甲
甲
②1mol乙消耗NaHCO3的物质的量是甲的2倍
③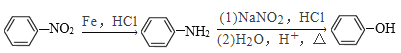
回答下列问题:
(1)甲可由已知①得到。
①甲中含有不饱和键的官能团名称为______。
②A→B为取代反应,A的结构简式为______。
③B→D的化学方程式为______。
(2)乙在一定条件下生成链状酯类有机高分子化合物的化学方程式为______。
(3)由丙经下列途径可得一种重要的医药和香料中间体J(部分反应条件略去):

①用化学方法除去E中残留的少量丙(室温时E和丙呈液态,忽略它们在水中的溶解),第1步加入试剂的名称为______ ,第2、3操作分别是过滤、分液。
②经E→G→H保护的官能团是______,可以表征有机化合物中存在何种官能团的仪器是______。
③J的同分异构体中在核磁共振氢谱上显示为两组峰,峰面积比为3:2的链状且不存在支链的异构体共有______ 种(不含立体异构),其中某异构体L中的官能团都能与H2发生加成反应,则L的结构简式为______ (只写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期五种元素 A、B、C、D、E,原子序数依次增大。已知:A 原子的核外电子数与电子层数相等;B 元素原子的核外 p 电子数比 s 电子数少 1 个;C 原子的第一至第四电离能为 I1=738 kJ·mol-1,I2=1 451 kJ·mol-1,I3=7 733 kJ·mol-1,I4=10 540 kJ·mol-1;D 原子核外所有 p 轨道为全充满或半充满;E 元素的族序数与周期序数的差为 4。
(1)写出 C 单质在 B 单质中燃烧的化学方程式:_______________________________________。
(2)某同学根据题目信息和掌握的知识分析 C 的核外电子排布为![]() 该同学所画的轨道式违背了_______________原理(或规则)。
该同学所画的轨道式违背了_______________原理(或规则)。
(3)用电子式表示 BA3 的形成过程:__________________________。
(4)DE3 中心原子杂化方式为_______________,其空间构型为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
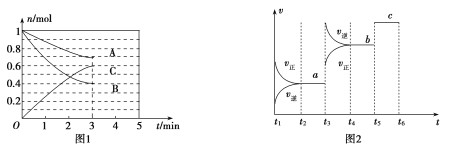
(1)该反应的化学方程式为_____________,此反应平衡常数的表达式为![]() ________。
________。
(2)从开始到平衡C的平均反应速率v(C)=________________。该反应的![]() ________0。(填“
________0。(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)
(3)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在![]() 时刻改变的外界条件是________。
时刻改变的外界条件是________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
|
|
|
|
|
|
![]() 、
、![]() 、
、![]() 之间的关系为_______(用“
之间的关系为_______(用“![]() ”、“
”、“![]() ”或“
”或“![]() ”连接)。
”连接)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com