
【题目】钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
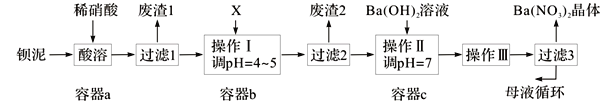
已知:i .Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii .Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii. Kap(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)Ba(FeO2)2中Fe的化合价是 。
(2)二氧化碳与水作用形成的碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式 。
(3)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式和必要的文字说明提纯原理: 。
(4)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为: 。
(5)该厂结合本厂实际,选用的X为 (从下列选项中选择);废渣2为 (写出化学式)。
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④ Ba(OH)2
(6)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(7)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为 。
【答案】
(1)+3
(2)ClO-+ CO2 + H2O=HClO + HCO3-
(3)BaSO4(s)+CO32-(aq) ![]() BaCO3(s)+SO42-(aq),增大碳酸根离子的浓度,使平衡正向移动从而除去BaSO4杂质
BaCO3(s)+SO42-(aq),增大碳酸根离子的浓度,使平衡正向移动从而除去BaSO4杂质
(4)Ba(FeO2)2+8HNO3 = Ba(NO3)2+2Fe(NO3)3+4H2O;
(5)③; Fe(OH)3;
(6)c;
(7)![]() ×100%
×100%
【解析】
试题分析:
(1)Ba为+2价,O为-2价,根据化合价规则可得Fe为+3价;
(2)酸越弱,电离常数越小,所以根据电离常数可知酸性强弱顺序为碳酸>次氯酸>碳酸氢钠,所以依据较强酸制备较弱酸可知向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入少量二氧化碳发生反应的离子方程式为ClO-+ CO2 + H2O=HClO + HCO3-;
(3)在溶液中存在平衡:BaSO4(s)+CO32-(aq) ![]() BaCO3(s)+SO42-(aq),加入饱和的碳酸钠溶液,增大碳酸根离子的浓度,使平衡正向移动生成碳酸钡而除去BaSO4杂质;
BaCO3(s)+SO42-(aq),加入饱和的碳酸钠溶液,增大碳酸根离子的浓度,使平衡正向移动生成碳酸钡而除去BaSO4杂质;
(4)Ba(FeO2)2与HNO3反应生成两种硝酸盐,则根据原子守恒两种硝酸盐应该是硝酸铁和硝酸钡,同时还有水生成,反应的化学方程式为Ba(FeO2)2+8HNO3 = Ba(NO3)2+2Fe(NO3)3+4H2O;
(5)X是调节溶液pH,以沉淀溶液中的铁离子,由于不能引入杂质,实验根据本长的实际应该选择碳酸钡,答案选③;氢氧化铁在pH=3.2时就已经完全沉淀,则滤渣2的主要成分是Fe(OH)3;
(6)过滤3后的母液中含有氢氧化钡,因此应循环到容器c中;
(7)mg沉淀应该是硫酸钡,则碳酸钡的质量是![]() ,所以其纯度为
,所以其纯度为![]() ×100%。
×100%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是

A. 原电池的总反应为 Fe+Cu2+=Fe2++Cu
B. 反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过0.2 mol电子
C. 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑
D. 盐桥中是 KNO3溶液,则盐桥中NO3-移向乙烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下将6mol的A及6molB混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
(1)平衡时D的浓度= ,
(2)B的平均反应速率v(B)= ,
(3)x= ,
(4)开始时容器中的压强与平衡时的压强之比为 (化为最箭整数比)
II.将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)

(5) (填A或B)处电极入口通甲烷,其电极反应式为 ;
(6)当消耗甲烷的体积为11.2 L(标准状况下)时,则消耗KOH的物质的量为 。
(7)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4gNH3转移的电子数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。 旦泄露需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
I.已知:氰化钠化学式为NaCN,氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化钠
(1) CN-中C元素显+2价,N元素显-3价,则非金属性N_______C(填“﹤”“﹥”或“=”),请设计实验证明: 。
(2) NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是 。
(3) 氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3==NaSCN+ Na2SO3;已知:NaSCN中S为-2价,处理1mol NaCN,反应中转移电子的物质的量为 。
Ⅱ.某化学兴趣小组在实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过如右图所示装置制备Na2S2O3。

(4)b装置的作用是________________。c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有________________________。
(5)实验结束后,在e处最好连接盛______________(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,然后再__________________,最后拆除装置。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50 mg/L。
②![]() AgI呈黄色,且CN -优先与Ag+反应。
AgI呈黄色,且CN -优先与Ag+反应。
实验如下:取20.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000 ×
10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
(6)滴定终点的判断方法是_______________。
(7)处理后的废水是否达到排放标准____________(填“是”或“否”),写出判断依据
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由青蒿素合成衍生药物蒿甲醚的合成路线如下:

A.①、②反应依次为加成反应、取代反应
B.上述三种有机物的含氧官能团完全相同
C.青蒿素因含酯基具有氧化性和杀菌功能
D.蒿甲醚的化学式为C16H24O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)由乙烯制取聚乙烯的化学方程:_______________。
(2)写出下列物质的结构简式;
①2,3-二甲基戊烷____________________________________
②3-甲基-2-戊烯___________________________________
③间二甲苯____________________________
(3)分子中含有5个碳原子的链状单炔烃的分子式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是化学实验室中常见的有机物,它易溶于水并有特殊香味,B的产量是衡量一个国家石油化工发展水平的标志,他们之间并能进行如图所示的相互转化。

(1)写出A的化学式_________。
(2)写出下列反应的化学方程式
反应①:______________________;
反应③:______________________;
反应④:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2,5-二羟基苯甲酸甲酯俗称龙胆酸甲酯,可由龙胆酸与甲醇酯化得到,是合成制药中的常见中间体。其结构如右图所示。
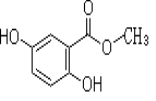
回答以下问题:
(1)龙胆酸甲酯所含官能团名称为 _________________
(2)龙胆酸甲酯的分子式为________________
(3)下列有关龙胆酸甲酯的描述,正确的是______________(填字母)。
a.能发生消去反应
b.能与氢气发生加成反应
c.能与浓溴水反应
(4)龙胆酸甲酯与足量氢氧化钠溶液反应的化学方程式___________________ 。
(5)写出满足下列条件的龙胆酸的两种同分异构体的结构简式_________、____________。
① 能发生银镜反应; ② 能使FeCl3溶液显色;
③ 酯类 ④苯环上的一氯代物只有两种
(6)已知X及其它几种有机物存在如下转化关系,且测得C4H8含有一个支链,A的核磁共振氢谱图中有两个吸收峰。
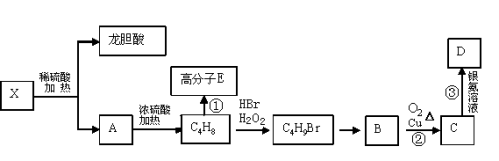
写出①的化学方程式____________________________________。
②的化学方程式______________________________________。
③化学方程式 ________________________________________。
写出X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:_______与盐酸反应最剧烈,______与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理_______说明理由:_____________________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
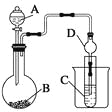
(3)仪器A的名称为____,干燥管D的作用是______________。
(4) 实验验证氯的非金属性大于硫:A中放浓盐酸、B中放KMnO4、C中盛放__________,离子方程式为____________。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气.
(5)若要证明非金属性:C>Si,则A中加盐酸、B中加Na2CO3、C中加________,观察到C中溶液的现象为____________________。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________溶液的洗气瓶.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com