
【题目】关于胶体的下列说法中错误的是( )
A.胶体在光束透过时能产生丁达尔效应
B.不能用丁达尔效应区分溶液与胶体
C.胶体是混合物
D.胶体粒子的直径介于10-9m---10-7m之间
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学为了探究“在相同的温度和压强下、相同体积的任何气体都含有相同数目和分子”,他们设计了如下实验装置并记录相关实验数据。实验装置:
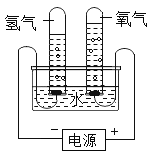
部分实验数据:
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2物质的量分别是__________mol、___________mol。
(2)该温度下,气体摩尔体积是________________。
(3)假设电解H2O速率相同,2分钟时试管内收集到的H2的体积是___________mL。
(4)根据以上实验得出如下结论,其中不正确的是_________________。
A. 气体摩尔体积与气体的温度相关
B. 在该实验条件下,3 mol O2的气体摩尔体积为74.58 L/mol
C. 同温、同压下,2 mol O2和2 mol CO和CO2混合气体的体积相同
D. 该实验条件下,O2的密度为1.287 g/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于漂白粉的叙述正确的是( )
A.漂白粉的有效成分是Ca(ClO)2和CaCl2
B.漂白粉在空气中久置后会变质失效
C.漂白粉的有效成分Ca(ClO)2不稳定,易分解
D.在使用漂白粉时要加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如下图所示,则原稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为( )

A. 4∶1 B. 3∶1 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有许多重要的化合物,除中学化学常见的三种氧化物和两种氢氧化物外,还有许多盐。FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。现用绿矾对某工厂废水(含有强氧化性离子Cr2O![]() )进行处理。
)进行处理。
(1)绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:
________________________________________________________________________。
(2)试配平:________Fe2++________Cr2O![]() +________===________Fe3++________Cr3++________H2O
+________===________Fe3++________Cr3++________H2O
(3)若该废水经处理后Cr3+的含量为1×10-2 mol·m-3,理论上83.4 kg绿矾可以处理该废水________吨(已知废水的密度为1 g·cm-3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将H2(g)和I2(g)各0.9 mol的气态混合物充入2 L的密闭容器中,充分反应,5 min后达到平衡,测得c(HI)=0.3 mol/L。(写出计算过程)
(1)计算从反应开始至达到平衡,用H2(g)表示的反应速率________________。
(2)保持温度不变,若向上述容器中充入H2(g)和I2(g)各2 mol,求达到平衡时I2(g)的物质的量浓度___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种生活中常用的食品添加剂,但使用时必须严格控制其用量。某兴趣小组将下图装置连接起来制备NaNO2(装置可重复使用,A中加热装置已略去)。

兴趣小组查阅资料可知:
①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+;
③在酸性条件下NaNO2能把I-氧化为I2,NO2-被还原为NO;Na2S2O3与I2的反应为2Na2S2O3+I2=Na2S4O6+2NaI
(1)连接装置的顺序为________。
(2)装置A三颈烧瓶中发生反应的化学方程式为______________;为保证制得的亚硝酸纯度,装置B中盛放的试剂可能是_________(填序号)。
A.P2O5 B.碱石灰 C.无水CaCl2 D.生石灰
(3)C装置的目的是_____________;E装置的作用是_____________。
(4)利用NaNO2的氧化性来测定其纯度的步骤是:准确称取mgNaNO2样品放人锥形瓶中,加适量水溶解,再加过量clmol·L-lKI溶液VlmL和几滴淀粉溶液,然后滴加稀硫酸,用c2mol·L-1Na2S2O3溶液滴定消耗V2mL。
①滴定终点的判断方法是____________;②NaNO2的质量分数__________%(写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.棕色集气瓶中装有Cl2和O2,可用观察颜色的方法把它们区别开来
B.棕色集气瓶中装有Cl2和O2,可用加水的方法把它们区别开来
C.某混合气体若为无色气体,则混合气体中肯定不含大量Cl2
D.某混合气体若为无色气体,则混合气体中肯定不含大量O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要合金材料和催化剂,其储氢合金可作为一种新型锌离子电池的负极材料,该电池以Zn(CF3SO3)2为电解质,以有缺陷的阳离子型ZnMn2O4为电极,成功获得了稳定的大功率电流。
(1)基态钒原子的核外电子排布式为________,其排布时能量最高电子所占据能级的原子轨道有________个伸展方向。
(2)VO2+可与多种物质形成配合物,与氧同周期且第一电离能比氧大的主族元素有____(写元素符号)。
(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为_______,与CN-互为等电子体的一种分子的化学式为__________。
(4)三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF3、H2O2等为主要原料来制取。
①H2O2分子中O原子的杂化方式为________。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为__________。

(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2所示,该晶胞中S2-的配位数为____。
(6)镧镍合金是重要储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为___________。
②该镧镍合金储氢后氢气的密度为________(用NA表示阿伏加德罗常数的数值)g.cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com