
【题目】向某HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如下图所示,则原稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为( )

A. 4∶1 B. 3∶1 C. 2∶1 D. 1∶1
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】某元素原子最外层只有1个电子,它跟卤素相结合时,所形成的化学键是( )
A.一定形成共价键
B.一定形成离子键
C.可能形成共价键,也可能形成离子键
D.以上说法都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】示踪原子法是研究化学反应的重要方法之一,下列化学方程式正确的是
A. 2Na2O2+2H218O= 4NaOH+18O2 ↑
B. 2KMnO4+5H218O +3H2SO4= K2SO4+2MnSO4+ 518O2↑+8H2O
C. CH3C18OOH + CH3OH![]() CH3CO18OCH3+H2O
CH3CO18OCH3+H2O
D. 6H37Cl+ NaClO3==NaCl+37Cl2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂硫电池是一种新型储能电池,放电时的总反应为2Li+xS=Li2Sx。以该电池为电源制备甲烷的原理如图所示。
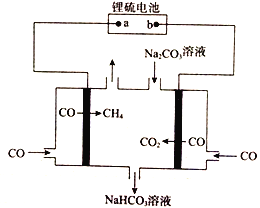
下列说法正确的是
A. b为锂硫电池的负极
B. 锂硫电池的正极反应式为Li-e-=Li+
C. 阳极反应式为CO+3CO32-+2H2O-2e-==4HCO3-
D. 该装置工作时溶液中的CO32-增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据反应8NH3+3Cl2![]() 6NH4Cl+N2,回答下列问题:
6NH4Cl+N2,回答下列问题:
①该反应中氧化剂是______________,氧化产物是___________________。
②该反应中被氧化的物质与被还原的物质物质的量之比为________________。
(2)某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。已知存在下列转化关系:HNO3→NO,请完成下列各题:
①该反应的氧化剂是__________,还原剂是___________。
②该反应中1 mol氧化剂____________(填“得到”或“失去”)____________mol电子。
③当有0.1 mol HNO3被还原,此时生成标准状况下NO的体积是__________L。
④请把各物质填在下面空格处,需配平:
□______+□______=□______+□______+□______+□
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年全国各地雾霾严重,为有效控制雾霾,各地积极采取措施改善大气质量。研究并有效控制空气中氮氧化物、碳氧化物等污染物是一项重要而艰巨的工作。
I.氮氧化物的研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应: 2NO(g)+O2(g) ![]() 2NO2(g),下列状态能说明该反应达到化学平衡的是_______
2NO2(g),下列状态能说明该反应达到化学平衡的是_______
A.混合气体的密度保持不变 B.NO的转化率保持不变
C.NO和O2的物质的量之比保持不变 D.O2的消耗速率和NO2的消耗速率相等
(2)已知反应:2NO(g) ![]() N2(g)+O2(g) ΔH<0,在不同条件时N2的体积分数随时间(t)的变化如图所示。根据图象可以判断曲线R1、R2对应的是下列反应条件中的______ (填字母序号)。
N2(g)+O2(g) ΔH<0,在不同条件时N2的体积分数随时间(t)的变化如图所示。根据图象可以判断曲线R1、R2对应的是下列反应条件中的______ (填字母序号)。
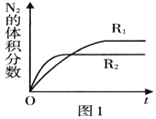
A.压强 B.温度 C.催化剂
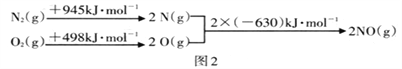
根据如图中的能量变化数据,计算反应:2NO(g) ![]() N2(g)+O2(g) 的ΔH=__________
N2(g)+O2(g) 的ΔH=__________
II.碳氧化物的研究
(3)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0,现在体积为1L的恒容密闭容器(如图甲)中通入1molCO和2molH2,测定不同时间、不同温度(T)下容器中CO的物质的量,如下表:
CH3OH(g) ΔH<0,现在体积为1L的恒容密闭容器(如图甲)中通入1molCO和2molH2,测定不同时间、不同温度(T)下容器中CO的物质的量,如下表:

请回答:
T1_____ T2(填“>”或“<”或“=”)。已知T2℃时,第20min时容器内压强不再改变,此时H2的转化率为_________ 。
(4)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6 mol·L-1),需调节溶液pH范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于胶体的下列说法中错误的是( )
A.胶体在光束透过时能产生丁达尔效应
B.不能用丁达尔效应区分溶液与胶体
C.胶体是混合物
D.胶体粒子的直径介于10-9m---10-7m之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )
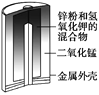
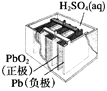
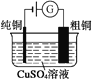
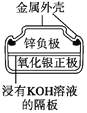
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种物质,并存在如下转化关系,其中E为黑色粉末。

I、利用右图所示的实验装置进行C与水的反应,回答下列有关问题:

(1)在实验前首先___________如何操作___________将分液漏斗中的水滴入试管,然后:
①在导管口处进行适当操作,观察现象。
②观察烧杯中的现象为:___________。根据所观察现象可得到的两个结论是______、_____。
③写出试管中反应的化学方程式_____________。
(2)已知水与C反应生成D及另一种化合物F,在通常状况下,足量F的稀溶液与含溶质为1mol的稀盐酸完全反应时放出akJ的热量,请写出该反应的热化学方程式_______。
II.在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X。为检验X的性质,设计如下图所示实验装置:

(1)请写出此实验中制备单质气体X的离子反应方程式___________。
(2)实验过程中,观察到装置III中品红试纸的红色褪去,并未观察到“无明显变化”这一预期现象。为了达到这一预期现象,你认为应该如何改进?___________。
(3)实验结束后,装置IV中可观察到现象是_________,若滴加两滴胶头滴管中的试剂,观察到溶液呈红色,胶头滴管中的试剂为:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com