
【题目】现有A、B、C、D、E五种物质,并存在如下转化关系,其中E为黑色粉末。

I、利用右图所示的实验装置进行C与水的反应,回答下列有关问题:

(1)在实验前首先___________如何操作___________将分液漏斗中的水滴入试管,然后:
①在导管口处进行适当操作,观察现象。
②观察烧杯中的现象为:___________。根据所观察现象可得到的两个结论是______、_____。
③写出试管中反应的化学方程式_____________。
(2)已知水与C反应生成D及另一种化合物F,在通常状况下,足量F的稀溶液与含溶质为1mol的稀盐酸完全反应时放出akJ的热量,请写出该反应的热化学方程式_______。
II.在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X。为检验X的性质,设计如下图所示实验装置:

(1)请写出此实验中制备单质气体X的离子反应方程式___________。
(2)实验过程中,观察到装置III中品红试纸的红色褪去,并未观察到“无明显变化”这一预期现象。为了达到这一预期现象,你认为应该如何改进?___________。
(3)实验结束后,装置IV中可观察到现象是_________,若滴加两滴胶头滴管中的试剂,观察到溶液呈红色,胶头滴管中的试剂为:__________。
【答案】 检查装置的气密性 关闭分液漏斗的活塞,出气导管再按一导管,放入水槽液面下,用手捂大试管,若水槽中产生气泡,松开手导管中形成水柱,说明装置气密性良好 出现浑浊(或“产生白色沉淀”) 反应放热 有氧气生成 2Na2O2+2H2O=4NaOH+O2 ↑ NaOH (aq) +HC1(aq) = NaCl (aq) + H2O (l) △H=-akJ/mo1或H+ (aq) + OH-(aq) = H2O (1) △H=-akJ/mol MnO2+4H++2Cl- = Mn2++Cl2↑+2H2O 在装置II、III之间加入一个盛有浓硫酸的洗气瓶 溶液由浅绿色变为黄色 KSCN (合理答案即可)
【解析】E为黑色粉末,图中转化中均作催化剂,利用氯酸钾、过氧化氢在二氧化锰作催化剂条件下制备氧气,可推知固体A为KClO3、B为H2O2,E为MnO2,D为O2,淡黄色固体C能与水反应,C应为Na2O2。
I、(1)在实验前首先检查装置的气密性,关闭分液漏斗的活塞,出气导管再按一导管,放入水槽液面下,用手捂大试管,若水槽中产生气泡,松开手导管中形成水柱,说明装置气密性良好。②烧杯中的现象为:出现浑浊(或“产生白色沉淀”),过氧化钠与水反应生成氢氧化钠与氧气,反应放热,氢氧化钙的溶解度随温度升高而降低。根据所观察现象可得到的两个结论是反应放热、有氧气生成。③试管中反应的化学方程式 2Na2O2+2H2O=4NaOH+O2↑ 。(2)水与C过氧化钠反应生成D氧气及另一种化合物F氢氧化钠,在通常状况下,足量F氢氧化钠的稀溶液与含溶质为1mol的稀盐酸完全反应时放出akJ的热量,该反应的热化学方程式NaOH(aq)+HC1(aq)=NaCl(aq)+H2O(l) △H=-akJ/mo1或H+(aq)+OH-(aq)=H2O(1) △H=-akJ/mol;II.在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X,则无氧酸为HCl、X为Cl2,(1)实验中制备单质气体X的离子反应方程式MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O。(2)实验过程中,观察到装置III中品红试纸的红色褪去,并未观察到“无明显变化”这一预期现象。为了达到这一预期现象,加入装置Ⅲ中的氯气应干燥,应在装置II、Ⅲ之间加入一个盛有浓硫酸的洗气瓶;(3)氯气氧化亚铁离子生成铁离子,装置Ⅳ中可观察到溶液由浅绿色变为黄色;滴加试剂,观察到溶液呈血红色,应滴加KSCN溶液。


科目:高中化学 来源: 题型:
【题目】向某HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如下图所示,则原稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为( )

A. 4∶1 B. 3∶1 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.棕色集气瓶中装有Cl2和O2,可用观察颜色的方法把它们区别开来
B.棕色集气瓶中装有Cl2和O2,可用加水的方法把它们区别开来
C.某混合气体若为无色气体,则混合气体中肯定不含大量Cl2
D.某混合气体若为无色气体,则混合气体中肯定不含大量O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时,4v正(O2)=5v逆(NO)
B. 若单位时间内生成xmol NO的同时,消耗xmol NH3,则反应达到平衡状态
C. 若有5 mol O===O键断裂,同时有12 mol H—O键形成,此时必为化学平衡状态
D. 化学平衡时,化学反应速率关系是2v正(NH3)=3v逆(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一硝酸盐晶体,其化学式为M(NO3)xnH2O,相对分子质量为242g/mol, 取1.21g该晶体溶于水,配成100mL溶液,将此溶液倒入下图所示装置中,用石墨作电极进行电解,当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出。在A极得到金属0.32g.下列说法正确的是( )

A. 金属M的摩尔质量为64 B. x=4
C. n=3 D. C极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁和石墨作电极电解酸性废水,可将废水中的PO43-以FePO4(不溶于水)的形式除去,其装置如图所示。
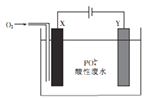
下列说法正确的是
A. 若X、Y电极材料连接反了,则仍可将废水中的PO43-除去
B. X极为石墨,该电极上发生氧化反应
C. 电解过程中Y极周围溶液的pH减小
D. 电解时废水中会发生反应:4Fe2++02-4H++4P043-=4FePO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要合金材料和催化剂,其储氢合金可作为一种新型锌离子电池的负极材料,该电池以Zn(CF3SO3)2为电解质,以有缺陷的阳离子型ZnMn2O4为电极,成功获得了稳定的大功率电流。
(1)基态钒原子的核外电子排布式为________,其排布时能量最高电子所占据能级的原子轨道有________个伸展方向。
(2)VO2+可与多种物质形成配合物,与氧同周期且第一电离能比氧大的主族元素有____(写元素符号)。
(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为_______,与CN-互为等电子体的一种分子的化学式为__________。
(4)三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF3、H2O2等为主要原料来制取。
①H2O2分子中O原子的杂化方式为________。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为__________。

(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2所示,该晶胞中S2-的配位数为____。
(6)镧镍合金是重要储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为___________。
②该镧镍合金储氢后氢气的密度为________(用NA表示阿伏加德罗常数的数值)g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活中的现象与氧化还原反应知识有关的是
A.食盐放在水中片刻后消失了
B.食醋洒在大理石台面上产生气泡
C.烧菜用过的铁锅,放置后常出现红棕色斑迹
D.用食醋可以除去水壶中的水垢[水垢的主要成分为CaCO3、Mg(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图l所示:

①在0~30小时内,CH4的平均生成速率vI、vⅡ和vⅢ从小到大的顺序为________;反应开始后的12小时内,在第____种催化剂的作用下,收集的CH4最多。
②将所得的CH4与H2O(g)通入聚焦太阳能反应器,发生CH4(g)+H2O(g)![]() CO(g)+3H2(g)反应,在一定条件下,CH4的平衡转化率与温度、压强的关系如图2所示,T2>T1,则上述反应的△H _______0(填“<”、“>”、“=”,下同),A、C处对应平衡常数(KA、KC)的大小关系为KA____KC。
CO(g)+3H2(g)反应,在一定条件下,CH4的平衡转化率与温度、压强的关系如图2所示,T2>T1,则上述反应的△H _______0(填“<”、“>”、“=”,下同),A、C处对应平衡常数(KA、KC)的大小关系为KA____KC。
③维持温度T2,将0.04mol CH4(g)和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=________。
④下列现象能说明该反应已经达到平衡状态的是________(填编号)。
A.容器内CH4、H2O、CO、H2单位物质的量之比为1:1:1:3
B.容器内气体的密度恒定
C.容器内气体的压强恒定
D.3v( CO)=v(H2)
(2)LiBH4为近年来常用的储氢材料。
①反应2LiBH4 =2LiH+2B +3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为____ mol。
②图3是2LiBH4/MgH2体系放氢焓变示意图,则:Mg(s) +2B(s) =MgB2(s) △H=____。
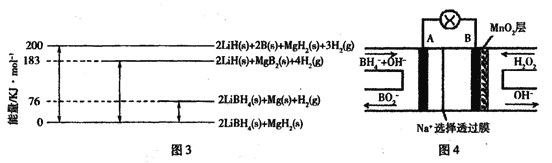
(3)图4是直接硼氢化钠一过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH___(填“增大”、“减小”或“不变”),负极的电极反应式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com