
【题目】下列生活中的现象与氧化还原反应知识有关的是
A.食盐放在水中片刻后消失了
B.食醋洒在大理石台面上产生气泡
C.烧菜用过的铁锅,放置后常出现红棕色斑迹
D.用食醋可以除去水壶中的水垢[水垢的主要成分为CaCO3、Mg(OH)2]
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )
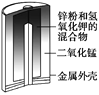
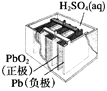
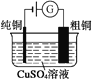
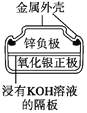
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种物质,并存在如下转化关系,其中E为黑色粉末。

I、利用右图所示的实验装置进行C与水的反应,回答下列有关问题:

(1)在实验前首先___________如何操作___________将分液漏斗中的水滴入试管,然后:
①在导管口处进行适当操作,观察现象。
②观察烧杯中的现象为:___________。根据所观察现象可得到的两个结论是______、_____。
③写出试管中反应的化学方程式_____________。
(2)已知水与C反应生成D及另一种化合物F,在通常状况下,足量F的稀溶液与含溶质为1mol的稀盐酸完全反应时放出akJ的热量,请写出该反应的热化学方程式_______。
II.在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X。为检验X的性质,设计如下图所示实验装置:

(1)请写出此实验中制备单质气体X的离子反应方程式___________。
(2)实验过程中,观察到装置III中品红试纸的红色褪去,并未观察到“无明显变化”这一预期现象。为了达到这一预期现象,你认为应该如何改进?___________。
(3)实验结束后,装置IV中可观察到现象是_________,若滴加两滴胶头滴管中的试剂,观察到溶液呈红色,胶头滴管中的试剂为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下向盛满水并倒置于水槽中的试管里先后通入4mL NO2、4 mL NO、5mL O2 , 经过一段时间后,试管里剩余的气体有( )
A.NO
B.O2
C.NO2和O2
D.NO和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年10月27日,世界工生组织国际癌症研究机构将三氯乙醛划为2A类致癌物,但它可用于生产氯霉素、合霉素等。某探究小组模拟备三氯乙醛自实验装置如图所示(夹持、加热装置均略去)。

已知:C2H5OH+4Cl2=CCl3CHO+5HCl,副反应是C2H5OH+HCl=C2H5Cl+H20。
容下列问题:
(1)写出装置A中发生反应的化学方程式:__________________。
(2)仪器b中冷凝水从________(填“p”或“q”,下同)口进,______口出。
(3)进入装置D的是纯净、干燥的Cl2,则装置B中的试剂为_____,装置C中的试剂为____。若撤去装置B,对实验的影响是____________________。
(4)实验时发现D中导管口处气泡速率过快,合理的解决方法是__________________。
(5)已知:CCl3CHO +OH-=CHCl3+HC00-; HC00-+I2=H++2I-+CO2↑ I2+2S2O32-=2I-+S4O62-
称取0.40g产品,配成待测溶液,加入20.00mL0.100mol/L碘标准溶液,再加入适量Na2C03溶液,反应完全后,加盐酸调节溶液的pH,并立即用0.020mol/L的Na2S2O3溶液滴定至终点。重复上述操作3次,平均消耗Na2S2O3溶液20.00mL。滴定时所用指示剂是_______,达到滴定终点的现象是______,测得产品的纯度为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是( )。

A. 正极反应式:Ca+2Cl--2e-=CaCl2
B. 放电过程中,Li+向负极移动
C. 每转移0.1 mol电子,理论上生成20.7 g Pb
D. 常温时,在正、负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠和氯化钠溶液等体积混合后,钠离子浓度为0.7mol·L-1, 硫酸根离子的浓度为0.2mol·L-1,则混合液中氯离子的浓度为:
A.0.15mol·L-1B.0.3mol·L-1C.0.45mol·L-1D.0.2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校的化学兴趣小组利用下列实验装置探究二氧化硫的性质,已知Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O,E中所装气体具有刺激性气味,能使湿润的红色石蕊试纸变蓝。

实验开始时关闭K2打开K1,从分液漏斗中向烧瓶内加入浓硫酸。
(1)B中的现象是________________。
(2)写出C中反应的化学方程式:_______________________________________。
(3)D的作用是___________________________________________________,
反应的离子方程式为_______________________________________________。
(4)A中反应完成后,关闭K1,打开K2,将E中的气体注入B中,观察到B中现象是________________________,
反应的离子方程式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4FeO42-+10H2O=4Fe(OH)3↓+8OH-+3O2↑ ,测得c(FeO42-)在不同条件下变化如图甲、乙、丙、丁所示:

下列说法正确的是
A. 图甲表明,其他条件相同时,温度越低FeO42-转化速率越快
B. 图乙表明,其他条件相同时,碱性越强FeO42-转化速率越快
C. 图丙表明,其他条件相同时,钠盐都是FeO42-优良的稳定剂
D. 图丁表明,其他条件相同时,碱性条件下Fe3+能加快FeO42-的转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com