
 .塑料制品是人类日常生活中使用量最大的合成高分子材料.大量塑料制品的生产和使用,给人们的生活带来了极大的方便,同时也造成了严重的环境问题--白色污染.当今白色污染问题已得到了人们应有的重视,一些科学家也成功地寻找到了治理白色污染的有效途径.结合学过的知识,回答下列问题:
.塑料制品是人类日常生活中使用量最大的合成高分子材料.大量塑料制品的生产和使用,给人们的生活带来了极大的方便,同时也造成了严重的环境问题--白色污染.当今白色污染问题已得到了人们应有的重视,一些科学家也成功地寻找到了治理白色污染的有效途径.结合学过的知识,回答下列问题: .
.分析 (1)乙烯发生加聚反应生成聚乙烯,据此写出反应的化学方程式;
(2)用聚苯乙烯、聚丙烯、聚氯乙烯等高分子化合物制成的各类生活塑料制品在自然界中难于降解处理,以致造成城市环境严重污染的现象,长期堆积会破坏土壤,污染地下水,危害海洋生物的生存,造成海难事件等;
(3)①苯和甲苯的沸点较低,泽尔试管B收集到的产品是苯和甲苯;根据苯和甲苯分子中等效H原子数目判断其一氯代物;
②烯烃能够与溴水发生加成反应而使溴水褪色;
③C中逸出的气体为甲烷和氢气,写出氢气和甲烷的用途.
解答 解:(1)乙烯发生加聚反应生成聚乙烯的化学方程式为:nCH2═CH2$\stackrel{引发剂}{→}$ ,
,
故答案为:nCH2═CH2$\stackrel{引发剂}{→}$ ;
;
(2)用聚苯乙烯、聚丙烯、聚氯乙烯等高分子化合物制成的各类生活塑料制品在自然界中难于降解处理,以致造成城市环境严重污染的现象,长期堆积会破坏土壤,污染地下水,危害海洋生物的生存,造成海难事件等,所以①②③④都属于塑料废弃物的危害,
故答案为:D;
(3)①常温下苯和甲苯为液态,所以在试管B收集到的产品是苯和甲苯,二者的结构简式分别为: 、
、 ;苯分子中只含有1种等效H,其一氯代物只有1种,甲苯分子中含有4种H原子,其一氯代物有4种,
;苯分子中只含有1种等效H,其一氯代物只有1种,甲苯分子中含有4种H原子,其一氯代物有4种,
故答案为:苯;甲苯;一种;四种;
②进入C中气体有氢气、甲烷、乙烯、丙烯,其中烯烃与溴发生加成反应,使溴水褪色,
故答案为:溴水褪色;
③最后得到的气体是甲烷和氢气,氢气可以用于合成氨工业,甲烷可以做燃料或有机化工原料,
故答案为:合成氨原料;作燃料或有机化工原料.
点评 本题考查乙炔的制备、同分异构体判断、有机物结构与性质等知识,题目难度中等,明确乙烯的化学性质为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol O2和 0.3mol H2O | |
| B. | 0.1mol H2SO4和3.6g H2O | |
| C. | 0.1mol MgSO4•7H2O和0.1mol C12H22O11(蔗糖) | |
| D. | 6.02×1023个CO2与0.1mol KMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
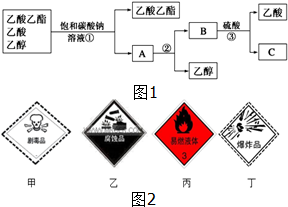 (1)如图1是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,在上述实验过程中,所涉及的三次分离操作的名称分别是①分液②蒸馏③蒸馏.
(1)如图1是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,在上述实验过程中,所涉及的三次分离操作的名称分别是①分液②蒸馏③蒸馏.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如下图所示.正极反应式为PbSO4+2Li++2e-=Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如下图所示.正极反应式为PbSO4+2Li++2e-=Li2SO4+Pb.下列说法不正确的是( )| A. | 放电过程中,Li+向正极移动 | |
| B. | 常温下电解质是不导电的固体,电池不工作 | |
| C. | 每转移0.1 mol 电子,理论上生成20.7 g Pb | |
| D. | 该电池总反应为 PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂可增大该反应速率 | |
| B. | 增大O2的浓度能加快反应速率 | |
| C. | 该反应达到平衡时,正、逆反应速率相等但不为0 | |
| D. | 一定条件下,2 mol SO2和1 mol O2反应可以得到2 mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O | |
| B. | 向水中通氯气:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 在强碱溶液中,次氯酸钠与Fe(OH)3 反应生成Na2FeO4,离子方程式:3ClO-+2Fe(OH)3═2FeO42-+H2O+3Cl-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
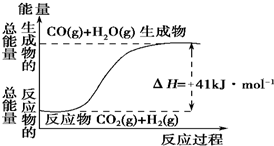 (1)根据如图所示情况,判断下列说法中正确的是B.
(1)根据如图所示情况,判断下列说法中正确的是B.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何反应都伴有能量的变化 | |
| B. | 化学反应中的能量变化可表现为热量的变化 | |
| C. | 反应物的总能量高于生成物的总能量时,发生吸热反应 | |
| D. | 反应物的总能量低于生成物的总能量时,发生吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com