
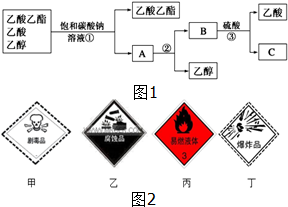
 (1)如图1是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,在上述实验过程中,所涉及的三次分离操作的名称分别是①分液②蒸馏③蒸馏.
(1)如图1是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,在上述实验过程中,所涉及的三次分离操作的名称分别是①分液②蒸馏③蒸馏.分析 (1)乙酸乙酯不溶于饱和碳酸钠溶液,可用分液的方法分离,溶液中的主要成分为乙酸钠和乙醇,蒸馏可得到乙醇,乙酸钠加入硫酸,蒸馏可得到乙酸;
(2)乙酸乙酯为易燃烧的液体,无毒,不具有腐蚀性,不能爆炸.
解答 解:(1)乙酸乙酯不溶于饱和碳酸钠溶液,可用分液的方法分离,溶液中的主要成分为乙酸钠和乙醇,二者沸点相差较大,蒸馏可得到乙醇,乙酸钠加入硫酸,得到乙酸和硫酸钠,二者沸点相差较大,蒸馏可得到乙酸,
故答案为:分液;蒸馏;蒸馏;
(2)乙酸乙酯为易燃烧的液体,无毒,不具有腐蚀性,不能爆炸,则必须贴上如图2中标签中的丙,故答案为:丙.
点评 本题考查物质的分离、提纯的实验方案,题目难度不大,侧重于考查学生分析能力、实验能力,注意把握物质的性质的异同.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
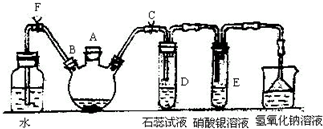 实验室制备溴苯可用如图所示的装置,填写下列空白:
实验室制备溴苯可用如图所示的装置,填写下列空白: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| B. | 增大压强,有利于SO2和O2反应生成SO3 | |
| C. | 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .塑料制品是人类日常生活中使用量最大的合成高分子材料.大量塑料制品的生产和使用,给人们的生活带来了极大的方便,同时也造成了严重的环境问题--白色污染.当今白色污染问题已得到了人们应有的重视,一些科学家也成功地寻找到了治理白色污染的有效途径.结合学过的知识,回答下列问题:
.塑料制品是人类日常生活中使用量最大的合成高分子材料.大量塑料制品的生产和使用,给人们的生活带来了极大的方便,同时也造成了严重的环境问题--白色污染.当今白色污染问题已得到了人们应有的重视,一些科学家也成功地寻找到了治理白色污染的有效途径.结合学过的知识,回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,其命名正确的是( )
,其命名正确的是( )| A. | 2-甲基-4-乙基-4-戊烯 | B. | 2-异丁基-1-丁烯 | ||
| C. | 4-甲基-2-乙基-1-戊烯 | D. | 2,4-二甲基-3-己烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com