
 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察如图,然后回答问题.| 1 |
| 2 |
| 1 |
| 2 |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
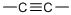 ,核磁共振氢谱显示只有一种化学环境的氢原子,则该烃的结构简式为
,核磁共振氢谱显示只有一种化学环境的氢原子,则该烃的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质燃烧不一定是放热反应 |
| B、放热反应不需要从外界吸收任何能量就能发生 |
| C、在一个确定的化学反应中,反应物总能量总是高于生成物总能量 |
| D、化学反应除了生成新的物质外,还伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2L甲烷中含有的氢原子数为2NA |
| B、标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA |
| C、常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA |
| D、常温下,1L 0.1 mol?L-1AlCl3溶液中含Al3+数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com