
| A、A为非电解质 |
| B、A为强电解质 |
| C、A既不是电解质也不是非电解持 |
| D、A为弱电解质 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、V<10 2c2=c1 |
| B、V>10 2c2=c1 |
| C、V>10 2c2<c1 |
| D、V>10 2c2>c1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、HCO3-、Cl-、Na+ |
| B、SO42-、NO3-、Ba2+、Cu2+ |
| C、MnO4-、Na+、K+、Mg2+ |
| D、Ca2+、Cl-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
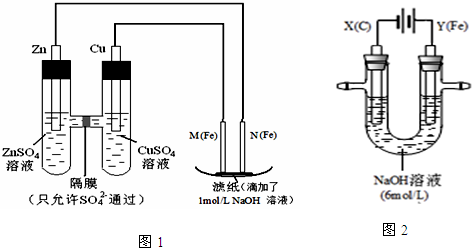
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+>Cu2+>Fe3+ |
| B、Fe3+>Fe2+>Cu2+ |
| C、Fe3+>Cu2+>Fe2+ |
| D、Cu2+>Fe2+>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
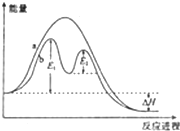
| A、反应过程b有催化剂参与 |
| B、该反应为放热反应,热效应等于△H |
| C、加入催化剂,可改变该反应的活化能 |
| D、有催化剂的条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放热反应一定能够自发进行 |
| B、放热反应的反应物总键能一定高于生成物总键能 |
| C、原电池反应一定是自发的氧化还原反应 |
| D、电解过程一定发生非自发的氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com