
ΓΨΧβΡΩΓΩΜ·ΚœΈοF «Κœ≥…ΩΙ÷ΉΝω“©ΈοΦΣΖ«ΧφΡαΒΡ“Μ÷÷÷–ΦδΧεΘ§Ω…Ά®Ιΐ“‘œ¬ΖΫΖ®Κœ≥…ΘΚ
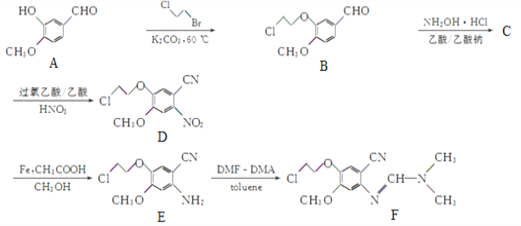
(1)Μ·ΚœΈοD÷–Κ§―θΙΌΡήΆ≈ΒΡΟϊ≥ΤΈΣ______ΚΆ______ΓΘ
(2)DΓζEΒΡΖ¥”Πάύ–ΆΈΣ______ΓΘ
(3)Μ·ΚœΈοCΒΡΖ÷Ή” ΫΈΣC10H10O2NClΘ§–¥≥ωCΒΡΫαΙΙΦρ ΫΘΚ______ΓΘ
(4)–¥≥ω¬ζΉψœ¬Ν–ΧθΦΰΒΡBΒΡ“Μ÷÷Ά§Ζ÷“λΙΙΧεΒΡΫαΙΙΦρ ΫΘΚ______ΓΘ
ΔΌΡήΖΔ…ζΥ°ΫβΖ¥”ΠΘ§Τδ÷–“Μ÷÷≤ζΈοΡή”κFeCl3»ή“ΚΖΔ…ζœ‘…ΪΖ¥”ΠΘΜ
ΔΎΖ÷Ή”÷–”–»ΐ÷÷≤ΜΆ§Μ·―ßΜΖΨ≥ΒΡ«βΓΘ
(5)“―÷ΣΘΚΔΌ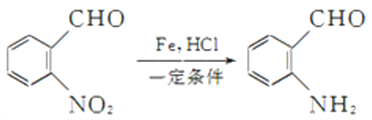 ΘΜ
ΘΜ
ΔΎR1Θ≠CHO+R2Θ≠NH2![]() R1Θ≠CH=NΘ≠R2ΓΘ
R1Θ≠CH=NΘ≠R2ΓΘ
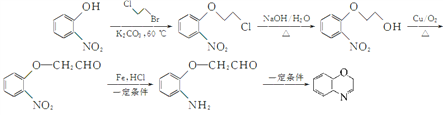
«κ“‘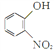 ”κClCH2CH2BrΈΣ‘≠Νœ÷Τ±Η
”κClCH2CH2BrΈΣ‘≠Νœ÷Τ±Η![]() Θ§–¥≥ωœύ”ΠΒΡΚœ≥…¬ΖœΏΆΦ(ΈόΜζ ‘ΦΝ»Έ―ΓΘ§Κœ≥…¬ΖœΏΝς≥ΧΆΦ ΨάΐΦϊ±ΨΧβΧβΗ…)_________ΓΘ
Θ§–¥≥ωœύ”ΠΒΡΚœ≥…¬ΖœΏΆΦ(ΈόΜζ ‘ΦΝ»Έ―ΓΘ§Κœ≥…¬ΖœΏΝς≥ΧΆΦ ΨάΐΦϊ±ΨΧβΧβΗ…)_________ΓΘ
ΓΨ¥πΑΗΓΩ Ο―Φϋ œθΜυ ΜΙ‘≠Ζ¥”Π 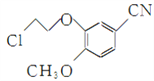
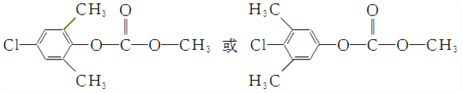
ΓΨΫβΈωΓΩ(1)ΗυΨίΜ·ΚœΈοDΒΡΫαΙΙΦρ ΫΩ…÷ΣΤδ÷–Κ§―θΙΌΡήΆ≈ΒΡΟϊ≥ΤΈΣΟ―ΦϋΚΆœθΜυΓΘ(2)DΓζE÷–œθΜυΉΣΜ·ΈΣΑ±ΜυΘ§“ρ¥ΥΖ¥”Πάύ–ΆΈΣΜΙ‘≠Ζ¥”ΠΓΘ(3)Μ·ΚœΈοCΒΡΖ÷Ή” ΫΈΣC10H10O2NClΘ§C…ζ≥…D”ΠΗΟ «±ΫΜΖ…œΒΡ«β‘≠Ή”±ΜœθΜυ»Γ¥ζΘ§‘ρCΒΡΫαΙΙΦρ ΫΈΣ ΓΘ(4)ΔΌΡήΖΔ…ζΥ°ΫβΖ¥”ΠΘ§Τδ÷–“Μ÷÷≤ζΈοΡή”κFeCl3»ή“ΚΖΔ…ζœ‘…ΪΖ¥”ΠΘ§ΥΒΟς¬»‘≠Ή”÷±Ϋ”Ν§‘Ύ±ΫΜΖ…œΜρ «Ζ”τ«Μυ–Έ≥…ΒΡθΞΜυΘΜΔΎΖ÷Ή”÷–”–»ΐ÷÷≤ΜΆ§Μ·―ßΜΖΨ≥ΒΡ«βΘ§ΥΒΟς±ΫΜΖ…œΒΡ»Γ¥ζΜυΕ‘≥Τ–‘±»Ϋœ«ΩΘ§“ρ¥ΥΖϊΚœΧθΦΰΒΡ”–ΜζΈοΫαΙΙΦρ ΫΈΣ
ΓΘ(4)ΔΌΡήΖΔ…ζΥ°ΫβΖ¥”ΠΘ§Τδ÷–“Μ÷÷≤ζΈοΡή”κFeCl3»ή“ΚΖΔ…ζœ‘…ΪΖ¥”ΠΘ§ΥΒΟς¬»‘≠Ή”÷±Ϋ”Ν§‘Ύ±ΫΜΖ…œΜρ «Ζ”τ«Μυ–Έ≥…ΒΡθΞΜυΘΜΔΎΖ÷Ή”÷–”–»ΐ÷÷≤ΜΆ§Μ·―ßΜΖΨ≥ΒΡ«βΘ§ΥΒΟς±ΫΜΖ…œΒΡ»Γ¥ζΜυΕ‘≥Τ–‘±»Ϋœ«ΩΘ§“ρ¥ΥΖϊΚœΧθΦΰΒΡ”–ΜζΈοΫαΙΙΦρ ΫΈΣ ΓΘΘ®5Θ©ΗυΨί“―÷Σ–≈œΔΫαΚœΡφΆΤΖ®Ω…÷Σ“‘
ΓΘΘ®5Θ©ΗυΨί“―÷Σ–≈œΔΫαΚœΡφΆΤΖ®Ω…÷Σ“‘ ”κClCH2CH2BrΈΣ‘≠Νœ÷Τ±Η
”κClCH2CH2BrΈΣ‘≠Νœ÷Τ±Η![]() ΒΡΚœ≥…¬ΖœΏΝς≥ΧΆΦΈΣ
ΒΡΚœ≥…¬ΖœΏΝς≥ΧΆΦΈΣ ΓΘ
ΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–”–ΙΊΒγ≥ΊΒΡΥΒΖ®≤Μ’ΐ»ΖΒΡ «( )
A. ÷Μζ…œ”ΟΒΡο°άκΉ”Βγ≥Ί τ”ΎΕΰ¥ΈΒγ≥Ί
B.«β―θ»ΦΝœΒγ≥ΊΩ…Α―Μ·―ßΡήΉΣΜ·ΈΣΒγΡή
C.Ά≠–Ω‘≠Βγ≥ΊΙΛΉς ±Θ§ΒγΉ”―ΊΆβΒγ¬Ζ¥”Ά≠ΒγΦΪΝςœρ–ΩΒγΦΪ
D.–ΩΟΧΗ…Βγ≥Ί÷–Θ§–ΩΒγΦΪ «ΗΚΦΪ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ¬Χ…ΪΜ·―ßΒΡΚΥ–Ρ «Ζ¥”ΠΙΐ≥ΧΒΡ¬Χ…ΪΜ·Θ§Φ¥“Σ«σ‘≠ΝœΈο÷ ÷–ΒΡΥυ”–‘≠Ή”Άξ»Ϊ±Μάϊ”Ο«“»Ϊ≤ΩΉΣ»κΤΎΆϊΒΡ≤ζΤΖ÷–Θ§œ¬Ν–Ιΐ≥Χ≤ΜΖϊΚœ’β“ΜΥΦœκΒΡΒΡ «
AΘ°ΦΉΆι”ꬻΤχΖ¥”Π÷Τ¬»Ζ¬ΘΚCH4ΘΪ3Cl2![]() CHCl3ΘΪ3HCl
CHCl3ΘΪ3HCl
BΘ°œ©Χΰ”κΥ°ΟΚΤχΖΔ…ζΒΡτ ΜυΚœ≥…Ζ¥”ΠΘΚRCHΘΫCH2+CO+H2![]() RCH2CH2CHO
RCH2CH2CHO
CΘ°ΦΉΆιΓΔCOΚœ≥…““Υα““θΞΘΚ2CH4 + 2CO![]() CH3COOCH2CH3
CH3COOCH2CH3
DΘ°““œ©Κœ≥…Ψέ““œ©ΘΚ![]()
![]()
![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘ΎΝΫΗω»ίΜΐœύΆ§ΒΡ»ίΤς÷–,“ΜΗω Δ”–HClΤχΧε,ΝμΓΣΗω Δ”–H2ΚΆCl2ΒΡΜλΚœΤχΧεΓΘ‘ΎΆ§Έ¬Ά§―Ιœ¬, ΝΫ»ίΤςΡΎΒΡΤχΧε“ΜΕ®ΨΏ”–œύΆ§ΒΡ( )
A. ‘≠Ή” ΐ B. ΟήΕ» C. ÷ ΝΩ D. ÷ Ή” ΐ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΆξ≥…œ¬Ν–Ης–ΓΧβΓΘ
Δώ.Α¥“Σ«σ ι–¥ΘΚ
Θ®1Θ©ΦΉΜυΒΡΒγΉ” Ϋ________ΓΘ
Θ®2Θ©©¹C3H7ΫαΙΙΦρ ΫΘΚ__________ΓΔ________ΓΘ
Θ®3Θ©![]() ΒΡœΒΆ≥ΟϋΟϊΈΣ__________ΓΘ
ΒΡœΒΆ≥ΟϋΟϊΈΣ__________ΓΘ
Θ®4Θ©œύΕ‘Ζ÷Ή”÷ ΝΩΈΣ72«“Ζ–ΒψΉνΒΆΒΡΆιΧΰΒΡΫαΙΙΦρ Ϋ__________ΓΘ
Θ®5Θ©Ζ÷Ή” ΫΈΣC5H12OΒΡ±ΞΚΆ“Μ‘Σ¥Φ”–Εύ÷÷Θ§≤ΜΡήΖΔ…ζ¥ΏΜ·―θΜ·ΒΡ¥ΦΖ÷Ή”ΫαΙΙΦρ Ϋ_____ΓΘ
ΔρΘ°Α¥“Σ«σ ι–¥œ¬Ν–Μ·―ßΖΫ≥Χ Ϋ
Θ®1Θ©2-ΦΉΜυ-1,3-ΕΓΕΰœ©”κΒ»Έο÷ ΒΡΝΩΒΡδε‘Ύ60Γφ ±ΖΔ…ζ1,4-Φ”≥…ΒΡΖ¥”ΠΘΚ__________ΓΘ
Θ®2Θ©““»©”κ“χΑ±»ή“ΚΥ°‘ΓΦ”»»ΘΚ________ΓΘ
Θ®3Θ©CH3CHClCOOCH2CH3”κ«β―θΜ·ΡΤΥ°»ή“ΚΙ≤»»ΘΚ________ΓΘ
Θ®4Θ©““Εΰ¥ΦΚΆ““ΕΰΥαΆ―Υ°≥…ΜΖθΞΘΚ________ΓΘ
ΔσΘ°”–“Μ÷÷”–ΜζΈοXΒΡΦϋœΏ Ϋ»γΆΦΥυ ΨΓΘ
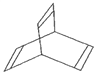
Θ®1Θ©XΒΡΖ÷Ή” ΫΈΣ________ΓΘ
Θ®2Θ©”–ΜζΈοY «XΒΡΆ§Ζ÷“λΙΙΧεΘ§«“ τ”ΎΖΦœψΉεΜ·ΚœΈοΘ§‘ρYΒΡΫαΙΙΦρ Ϋ «______ΓΘ
Θ®3Θ©Y‘Ύ“ΜΕ®ΧθΦΰœ¬Ω……ζ≥…ΗΏΖ÷Ή”Μ·ΚœΈοΘ§ΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ «______________ΓΘ
Θ®4Θ©X”κΉψΝΩΒΡH2‘Ύ“ΜΕ®ΧθΦΰœ¬Ζ¥”ΠΩ……ζ≥…ΜΖΉ¥ΒΡ±ΞΚΆΧΰZΘ§ZΒΡ“Μ¬»¥ζΈο”–____÷÷ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΖ¥”Π2SO2(g) + O2(g) ![]() 2SO3(g) ΠΛH = a kJ/molΘ§ΡήΝΩ±δΜ·»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®÷–Θ§≤Μ’ΐ»ΖΒΡ «Θ®ΓΓΓΓΘ©
2SO3(g) ΠΛH = a kJ/molΘ§ΡήΝΩ±δΜ·»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®÷–Θ§≤Μ’ΐ»ΖΒΡ «Θ®ΓΓΓΓΘ©
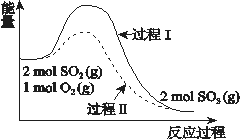
A. 2SO2(g) + O2(g) ![]() 2SO3(l) ΠΛH > a kJ/mol
2SO3(l) ΠΛH > a kJ/mol
B. Ιΐ≥ΧIIΩ…Ρή Ι”ΟΝΥ¥ΏΜ·ΦΝΘ§ Ι”Ο¥ΏΜ·ΦΝ≤ΜΩ…“‘ΧαΗΏSO2ΒΡΤΫΚβΉΣΜ·¬
C. Ζ¥”ΠΈοΕœΦϋΈϋ ’ΡήΝΩ÷°ΚΆ–Γ”Ύ…ζ≥…Έο≥…Φϋ ΆΖ≈ΡήΝΩ÷°ΚΆ
D. ΫΪ2molSO2(g) ΚΆ1mol O2(g)÷Ο”Ύ“ΜΟή±’»ίΤς÷–≥δΖ÷Ζ¥”ΠΚσΖ≈≥ωΜρΈϋ ’ΒΡ»»ΝΩ–Γ”Ύ©ßa©ß kJ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ÷¥ζΈόΜζΜ·―ßΕ‘ΝρΘ≠ΒΣΜ·ΚœΈοΒΡ―–ΨΩ «ΉνΈΣΜν‘ΨΒΡΝλ”ρ÷°“ΜΓΘΤδ÷–œ¬ΆΦ «“―Ψ≠Κœ≥…ΒΡΉν÷χΟϊΒΡΝρΘ≠ΒΣΜ·ΚœΈοΒΡΖ÷Ή”ΫαΙΙΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
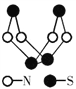
A. ΗΟΈο÷ ΒΡΖ÷Ή” ΫΈΣSN
B. ΗΟΈο÷ ΒΡΨßΧε÷–ΈΔΝΘΦδΉς”ΟΝΠ”–2÷÷
C. ΗΟΈο÷ ΨΏ”–ΚήΗΏΒΡ»έΓΔΖ–Βψ
D. ΗΟΈο÷ ”κΜ·ΚœΈοS2N2ΜΞΈΣΆ§ΥΊ“λ–ΈΧε
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»γΆΦΥυ ΨΘ§ΉΑ÷ΟΔώΈΣ–¬–ΆΒγ≥ΊΘ§Ζ≈Βγ ±BΒγΦΪΒΡΖ¥”Π ΫΈΣNaBr3ΘΪ2NaΘΪΘΪ2eΘ≠===3NaBrΘ§ΉΑ÷ΟΔρΈΣ«Π–νΒγ≥ΊΓΘ Ήœ»±’ΚœK1ΚΆK2Θ§Β±«Π–νΒγ≥Ί≥δΒγΫα χΚσΘ§ΕœΩΣK1Θ§±’ΚœK2ΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ®ΓΓΓΓΘ©
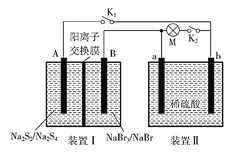
A. ±’ΚœK1ΓΔK2 ±Θ§ΟΩ”–0.1 mol NaΘΪΆ®ΙΐάκΉ”ΫΜΜΜΡΛΘ§ΉΑ÷ΟII»ή“Κ÷–”–0.1molΒγΉ”ΉΣ“Τ
B. ΉΑ÷ΟΔώΖ≈Βγ ±ΒΡAΒγΦΪΖ¥”Π ΫΈΣ2Na2S2-2eΘ≠===Na2S4ΘΪ2NaΘΪ
C. ΕœΩΣK1ΓΔ±’ΚœK2 ±Θ§bΒγΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣPbO2ΘΪ2eΘ≠ΘΪSO42-ΘΪ4HΘΪ===PbSO4ΘΪ2H2O
D. ΕœΩΣK1ΓΔ±’ΚœK2 ±Θ§ΉΑ÷ΟΔρ÷–SO42-œρaΒγΦΪ«®“Τ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ«κΑ¥“Σ«σΆξ≥…œ¬Ν–ΧνΩ’ΘΚ
Θ®1Θ©÷ ΝΩ÷°±»ΈΣ16ΓΟ7ΓΟ6ΒΡSO2ΓΔCOΓΔNOΖ÷Ή”Ηω ΐ÷°±»ΈΣ______ΓΘ
Θ®2Θ©1.204ΓΝ1024ΗωD2OΒΡ÷ ΝΩΈΣ______ΓΘ
Θ®3Θ©9.2g NOx÷–Κ§”–N‘≠Ή” ΐΈΣ0.2molΘ§‘ρx ΐ÷ΒΈΣ______ΓΘ
Θ®4Θ© 1L1mol/LΒΡAlCl3»ή“Κ÷–ΚΆ1.5L______mol/LΒΡMgCl2»ή“Κ÷–ΒΡ¬»άκΉ”≈®Ε»œύΒ»ΓΘ
Θ®5Θ©‘Ύ±ξΉΦΉ¥Ωωœ¬Θ§COΚΆCO2ΒΡΜλΚœΤχΧεΙ≤39.2 LΘ§÷ ΝΩΈΣ61 gΘ§‘ρΝΫ÷÷ΤχΧεΒΡΈο÷ ΒΡΝΩ÷°ΚΆΈΣ_______molΘ§Τδ÷–CO2ΈΣ__________molΓΘ
Θ®6Θ©œ÷”–100mL 2mol/LΒΡœΓHCl»ή“Κ”κΉψΝΩΒΡΧζ–ΦΖ¥”ΠΘ§ΫΪ…ζ≥…ΒΡFeCl2≈δ≥…400mL»ή“ΚΘ§¥Υ»ή“Κ÷–FeCl2ΒΡΈο÷ ΒΡΝΩ≈®Ε» «______________ΓΘ
Θ®7Θ©‘Ύ±ξΉΦΉ¥Ωωœ¬Θ§ΫΪ224L¬»Μ·«βΤχΧε»ή”Ύ635mLΒΡΥ°Θ®ΟήΕ»ΈΣ1g/cm3Θ©÷–Θ§ΥυΒΟ―ΈΥαΒΡΟήΕ»ΈΣ1.18g/cm3Θ§ΗΟ―ΈΥα÷–»ή÷ ΒΡ÷ ΝΩΖ÷ ΐ____________Θ§ΗΟ―ΈΥαΒΡΈο÷ ΒΡΝΩ≈®Ε»_______________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com