
【题目】请按要求完成下列填空:
(1)质量之比为16∶7∶6的SO2、CO、NO分子个数之比为______。
(2)1.204×1024个D2O的质量为______。
(3)9.2g NOx中含有N原子数为0.2mol,则x数值为______。
(4) 1L1mol/L的AlCl3溶液中和1.5L______mol/L的MgCl2溶液中的氯离子浓度相等。
(5)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g,则两种气体的物质的量之和为_______mol,其中CO2为__________mol。
(6)现有100mL 2mol/L的稀HCl溶液与足量的铁屑反应,将生成的FeCl2配成400mL溶液,此溶液中FeCl2的物质的量浓度是______________。
(7)在标准状况下,将224L氯化氢气体溶于635mL的水(密度为1g/cm3)中,所得盐酸的密度为1.18g/cm3,该盐酸中溶质的质量分数____________,该盐酸的物质的量浓度_______________。
【答案】5∶5∶4 40g 2 1.5mol/L 1.75 0.75 0.25mol/L 36.5% 11.8mol/L
【解析】
(1)根据n= ![]() 计算物质的量之比,由N=nNA可知分子数目之比等于其物质的量之比;
计算物质的量之比,由N=nNA可知分子数目之比等于其物质的量之比;
(2)D2O的摩尔质量为20g/mol,依据n= ![]() =
= ![]() 计算解答;
计算解答;
(3)依据n= ![]() 计算解答;
计算解答;
(4)1mol/L的AlCl3溶液中氯离子浓度为3mol/L,据此计算MgCl2溶液的物质的量浓度;
(5)根据n= ![]() 计算出混合气体的物质的量;设出CO和CO2的物质的量,然后分别根据气体总物质的量、总质量列式计算;
计算出混合气体的物质的量;设出CO和CO2的物质的量,然后分别根据气体总物质的量、总质量列式计算;
(6)根据氯原子守恒确定氯化亚铁的物质的量,再根据c= ![]() 计算氯化亚铁的物质的量浓度;
计算氯化亚铁的物质的量浓度;
(7)根据w=![]() ×100%;V=
×100%;V=![]() 计算溶液的体积,再根据c=
计算溶液的体积,再根据c=![]() 计算该盐酸的浓度。
计算该盐酸的浓度。
(1)SO2、CO、NO的质量比为16∶7∶6,其物质的量之比为 ![]() ∶
∶![]() ∶
∶![]() =5∶5∶4,所以其分子数之比等于物质的量之比为5∶5∶4,故答案为:5∶5∶4;
=5∶5∶4,所以其分子数之比等于物质的量之比为5∶5∶4,故答案为:5∶5∶4;
(2)1.204×1024个D2O的质量为![]() ×20g/mol=40g;故答案为:40g;
×20g/mol=40g;故答案为:40g;
(3)9.2g氮的氧化物NOx中含有N原子数为 ![]() ×1=0.2mol,解得x=2,故答案为:2;
×1=0.2mol,解得x=2,故答案为:2;
(4)1mol/L的AlCl3溶液中氯离子浓度为3mol/L,则氯离子浓度为3mol/L时,MgCl2溶液的物质的量浓度=![]() =1.5mol/L,故答案为:1.5mol/L;
=1.5mol/L,故答案为:1.5mol/L;
(5)标准状况下39.2L CO和CO2的混合气体的物质的量为:![]() =1.75mol,设混合气体中CO和CO2的物质的量分别为x、y,则
=1.75mol,设混合气体中CO和CO2的物质的量分别为x、y,则![]() ,解得:
,解得:![]() ,即混合气体中CO为1mol,二氧化碳的物质的量为0.75mol,故答案为:1.75;0.75;
,即混合气体中CO为1mol,二氧化碳的物质的量为0.75mol,故答案为:1.75;0.75;
(6)根据氯原子守恒得n(FeCl![]() =0.1mol,c(FeCl2)=
=0.1mol,c(FeCl2)= ![]() =0.25mol/L,故答案为:0.25mol/L;
=0.25mol/L,故答案为:0.25mol/L;
(7)224L氯化氢气体物质的量为:![]() =10mol,故HCl的质量=10mL×36.5g/mol =365g,水的质量为635mL×1g/mL=635g,该溶液质量分数为
=10mol,故HCl的质量=10mL×36.5g/mol =365g,水的质量为635mL×1g/mL=635g,该溶液质量分数为![]() ×100%=36.5%,该盐酸的体积为:
×100%=36.5%,该盐酸的体积为:![]() =
=![]() L,该盐酸的物质的量浓度为
L,该盐酸的物质的量浓度为![]() =11.8mol/L,故答案为:36.5%;11.8mol/L。
=11.8mol/L,故答案为:36.5%;11.8mol/L。


科目:高中化学 来源: 题型:
【题目】化合物F是合成抗肿瘤药物吉非替尼的一种中间体,可通过以下方法合成:
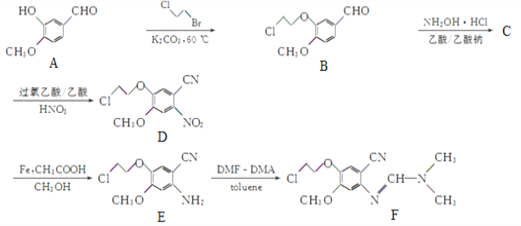
(1)化合物D中含氧官能团的名称为______和______。
(2)D→E的反应类型为______。
(3)化合物C的分子式为C10H10O2NCl,写出C的结构简式:______。
(4)写出满足下列条件的B的一种同分异构体的结构简式:______。
①能发生水解反应,其中一种产物能与FeCl3溶液发生显色反应;
②分子中有三种不同化学环境的氢。
(5)已知:①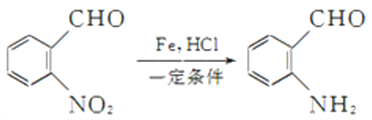 ;
;
②R1-CHO+R2-NH2![]() R1-CH=N-R2。
R1-CH=N-R2。
请以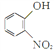 与ClCH2CH2Br为原料制备
与ClCH2CH2Br为原料制备![]() ,写出相应的合成路线图(无机试剂任选,合成路线流程图示例见本题题干)_________。
,写出相应的合成路线图(无机试剂任选,合成路线流程图示例见本题题干)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制0.5 mol/L的NaOH溶液500 mL:
(1)主要操作步骤的正确顺序是__________________________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;②用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;③待冷却至室温后,将溶液转移到500mL容量瓶中;④盖好瓶塞,反复上下颠倒,摇匀;⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________________________,烧杯的实际质量为_______________克。

(3)使用容量瓶前必须进行的一步操作是__________________________________。
(4)在配制过程中,其他操作都正确的,下列操作会引起误差偏高的是_______________
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视标线
⑤定容时仰视标线
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是几种原子的基态电子排布,电负性最大的原子是
A. 1s22s22p4 B. 1s22s22p63s23p3 C. 1s22s22p63s23p2 D. 1s22s22p63s23p64s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A. 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
B. 标准状况下,2.24 L CCl4中含有的氯原子数为0.4 NA
C. 1 mol丙烯醛分子中含有的双键数为NA
D. 1 mol CH4含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学需要配制450 mL 0.5 mol·L-1的NaOH溶液。请回答下列问题:
(1)在实验过程中用到的玻璃仪器有:玻璃棒、量筒、烧杯、______________、胶头滴管、试剂瓶。
(2)用托盘天平称量时,应将NaOH放在________称量,称取的固体质量为_______。
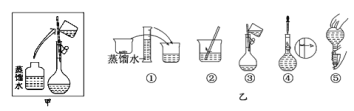
(3)配制时操作步骤如乙图所示,则甲图操作应在乙图中的___(填选项字母)之间。
A.①与② B.②与③ C.③与④ D.④与⑤
(4)配制过程中洗涤烧杯、玻璃棒2~3次的目的是______________________。
(5)定容滴加蒸馏水时,若不慎超过了刻度线,则处理的方法是______________。
(6)该同学实际配制NaOH溶液的浓度为0.6 mol·L-1,原因可能是____(填序号)。
a.砝码上有杂质
b.洗净的容量瓶中残留有少量水
c.称量NaOH固体时,采用了“左码右物”
d.定容时俯视刻度线
e.定容摇匀后发现液面低于刻度线又加入少许水调至刻度线
f.溶解固体的烧杯移液后未洗涤
g.定容前溶液未进行冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. π键是原子轨道以“肩并肩”方式相互重叠而形成的
B. 2个原子形成的多重共价键中,只能有一个是σ键,而π键可以是一个或多个
C. s电子与s电子间形成的键是σ键,p电子与p电子间形成的键是π键
D. 共价键一定有原子轨道的重叠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗结肠炎药物有效成分M的合成路线如下(部分反应略去试剂和条件)

已知:①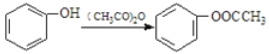 ②
②
(1)烃A的名称是_________________,G中的官能团名称是_______________________。
(2)反应①的反应条件是__________________,反应②的反应类型是_____________________。
(3) E与足量NaOH溶液反应的化学方程式是______________________________________。
(4)符合下列条件的D的同分异构体有_______种。其中核磁共振氢谱有4组峰且峰面积之比为6:2:1:1的结构简式是_____________________。(写出一种即可)
①属于芳香族化合物且苯环上有3个取代基
②能和NaHCO3溶液反应产生气体
(5)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A 为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A 为原料合成化合物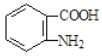 的合成路线_______________
的合成路线_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的(V) 的关系如图所示,试回答:

(1)0到a点之间的反应的离子方程式__________
(2)a到b点之间的反应的离子方程式__________
(3)b点之后的反应的离子方程式______________
(4)c 点CO2的体积__________mL(同温同压下)。
(5) 混合溶液中Ba(OH)2和NaOH 的物质的量之比为__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com