
【题目】实验室欲配制0.5 mol/L的NaOH溶液500 mL:
(1)主要操作步骤的正确顺序是__________________________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;②用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;③待冷却至室温后,将溶液转移到500mL容量瓶中;④盖好瓶塞,反复上下颠倒,摇匀;⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________________________,烧杯的实际质量为_______________克。

(3)使用容量瓶前必须进行的一步操作是__________________________________。
(4)在配制过程中,其他操作都正确的,下列操作会引起误差偏高的是_______________
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视标线
⑤定容时仰视标线
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
【答案】①③⑤②④ 物体与砝码放反了 27.4克 检漏 ④
【解析】
(1)配制一定物质的量浓度溶液的步骤是:称量、溶解、冷却、转移、洗涤、振荡、定容、摇匀,即该实验的步骤是①③⑤②④;
(2)称量时,应是左物有码,因此物体与砝码放反;根据左盘砝码的质量=烧杯质量+游码质量,烧杯的质量为(30-2.6)g=27.4g;
(3)使用容量瓶前需要检漏;
(4)根据c=n/V=m/MV,①、没有洗涤烧杯和玻璃棒,容量瓶中溶质的质量或物质的量减少,所配浓度偏低,故①不符合题意;
②转移时不慎有少量液体溅出,容量瓶中溶质物质的量或质量减少,所配溶液的浓度偏低,故②不符合题意;
③容量瓶是否干燥,对所配溶液浓度无影响,故③不符合题意;
④定容时俯视读数,容量瓶中溶液体积偏少,所配溶液浓度偏高,故④符合题意;
⑤定容时仰视标线,容量瓶中溶液的体积偏高,所配溶液浓度偏低,故⑤不符合题意;
⑥定容后,再加水稀释溶液,浓度偏低,故⑥不符合题意。


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的的是
A.甲烷与氯气反应制氯仿:CH4+3Cl2![]() CHCl3+3HCl
CHCl3+3HCl
B.烯烃与水煤气发生的羰基合成反应:RCH=CH2+CO+H2![]() RCH2CH2CHO
RCH2CH2CHO
C.甲烷、CO合成乙酸乙酯:2CH4 + 2CO![]() CH3COOCH2CH3
CH3COOCH2CH3
D.乙烯合成聚乙烯:![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其中下图是已经合成的最著名的硫-氮化合物的分子结构。下列说法正确的是( )
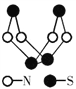
A. 该物质的分子式为SN
B. 该物质的晶体中微粒间作用力有2种
C. 该物质具有很高的熔、沸点
D. 该物质与化合物S2N2互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置Ⅰ为新型电池,放电时B电极的反应式为NaBr3+2Na++2e-===3NaBr,装置Ⅱ为铅蓄电池。首先闭合K1和K2,当铅蓄电池充电结束后,断开K1,闭合K2。下列说法正确的是( )
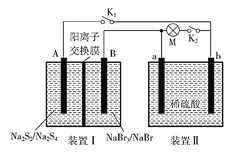
A. 闭合K1、K2时,每有0.1 mol Na+通过离子交换膜,装置II溶液中有0.1mol电子转移
B. 装置Ⅰ放电时的A电极反应式为2Na2S2-2e-===Na2S4+2Na+
C. 断开K1、闭合K2时,b电极的电极反应式为PbO2+2e-+SO42-+4H+===PbSO4+2H2O
D. 断开K1、闭合K2时,装置Ⅱ中SO42-向a电极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化锂(LiH)属于离子化合物。LiH跟水反应可以放出氢气。下列叙述中正确的是
A.LiH的水溶液显中性B.LiH中的氢离子可以被还原生成氢气
C.LiH是一种强氧化剂D.LiH中氢离子比锂离子的半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕集、利用CO2是人类可持续发展的重要战略之一。
(1)用太阳能工艺捕获CO2可得炭黑,其流程如图所示:

①捕获1mo1CO2转移电子的物质的量是_________。
②过程2反应的化学方程式是________。
(2)将CO2催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g),按投料比n(CO2):n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。
C2H4(g)+4H2O(g),按投料比n(CO2):n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。

①正反应的焓变△H_________0。
②提高CO2的转化率,可采用的方法是______。
a.增大n(CO2)与n(H2)的投料比
b.改变催化剂
c.缩小容器体积
③图中表示水的曲线是_____。
(3)电解CO2可制得多种燃料:下图是在酸性电解质溶液中,以惰性材料做电极将CO2转化为丙烯的原理模型。

①太阳能电池的正极是________。
②生成丙烯的电极反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氦原子电子云图的说法正确的是( )
A. 通常用小黑点来表示电子的多少,黑点密度大,电子数目大
B. 黑点密度大小,表示单位体积内电子出现的机会多少
C. 通常用小黑点来表示电子绕核作高速圆周运动
D. 电子云图是对运动无规律性的描述
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求完成下列填空:
(1)质量之比为16∶7∶6的SO2、CO、NO分子个数之比为______。
(2)1.204×1024个D2O的质量为______。
(3)9.2g NOx中含有N原子数为0.2mol,则x数值为______。
(4) 1L1mol/L的AlCl3溶液中和1.5L______mol/L的MgCl2溶液中的氯离子浓度相等。
(5)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g,则两种气体的物质的量之和为_______mol,其中CO2为__________mol。
(6)现有100mL 2mol/L的稀HCl溶液与足量的铁屑反应,将生成的FeCl2配成400mL溶液,此溶液中FeCl2的物质的量浓度是______________。
(7)在标准状况下,将224L氯化氢气体溶于635mL的水(密度为1g/cm3)中,所得盐酸的密度为1.18g/cm3,该盐酸中溶质的质量分数____________,该盐酸的物质的量浓度_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体粉末,可能由Na2CO3、Na2SO4、CuSO4、NH4Cl中的一种或几种组成,为了检验它们所含的物质,做了以下实验。
①将固体溶于水,搅拌后得到无色透明溶液;②往此溶液中滴加氯化钡溶液,有白色沉淀生成;③过滤,将沉淀置于稀盐酸中,发现沉淀不溶解。
(1)试判断:固体混合物中肯定含有____________________,生成白色沉淀的化学方程式______________________________________;肯定没有_____________________________;可能含有________________________
(2)检验是否含有可能存在的物质的实验方法是:________化学方程式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com