
【题目】捕集、利用CO2是人类可持续发展的重要战略之一。
(1)用太阳能工艺捕获CO2可得炭黑,其流程如图所示:

①捕获1mo1CO2转移电子的物质的量是_________。
②过程2反应的化学方程式是________。
(2)将CO2催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g),按投料比n(CO2):n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。
C2H4(g)+4H2O(g),按投料比n(CO2):n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。

①正反应的焓变△H_________0。
②提高CO2的转化率,可采用的方法是______。
a.增大n(CO2)与n(H2)的投料比
b.改变催化剂
c.缩小容器体积
③图中表示水的曲线是_____。
(3)电解CO2可制得多种燃料:下图是在酸性电解质溶液中,以惰性材料做电极将CO2转化为丙烯的原理模型。

①太阳能电池的正极是________。
②生成丙烯的电极反应式是___________。
【答案】 4mol 6FeO + CO2 = 2Fe3O4 + C < c b b 3CO2 + 18H+ + 18e- = CH2=CH-CH3 + 6H2O
【解析】(1)①从图中流程来看CO2~C~4mole-,故捕获1molCO2转移电子的物质的量是4mol;②过程2是FeO和CO2反应生成Fe3O4和C,故化学方程式为6FeO+CO2=2Fe3O4+C;(2)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,△H<0;②为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强或者减少n(CO2)与n(H2)的投料比,都能使平衡向正反应方向进行,催化剂不能改变平衡状态,答案选c;③随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线为CO2,由计量数关系可知b为水,c为C2H4的变化曲线;(3)①右侧电极产生氧气,说明是阳极,氢氧根放电,因此太阳能电池的正极是b;②电解时,二氧化碳在阴极上得到电子生成丙烯,电极反应式为3CO2+18H++18e-=CH3-CH=CH2+6H2O。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述中,正确的是( )
A.离子化合物中可能含有共价键B.氢键是一种特殊的共价键
C.I2的升华破坏了共价键D.非金属元素间不可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有下列电子排布式的原子中,半径最大的是( )
A. 1s22s22p63s23p5 B. 1s22s22p3
C. 1s22s22p2 D. 1s22s22p63s23p4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是( )
A. 将CH3COONa溶液从20℃升温至30℃,溶液中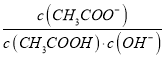 增大
增大
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C. 0.2 mol/L HCOOH 与 0.1 mol/L NaOH 等体积混合后:c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol/L CH3COONa 与 0.1 mol/L盐酸等体积混合后 (pH<7):c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制0.5 mol/L的NaOH溶液500 mL:
(1)主要操作步骤的正确顺序是__________________________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;②用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;③待冷却至室温后,将溶液转移到500mL容量瓶中;④盖好瓶塞,反复上下颠倒,摇匀;⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________________________,烧杯的实际质量为_______________克。

(3)使用容量瓶前必须进行的一步操作是__________________________________。
(4)在配制过程中,其他操作都正确的,下列操作会引起误差偏高的是_______________
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视标线
⑤定容时仰视标线
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
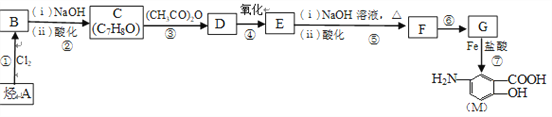
【题目】抗结肠炎药物有效成分M的合成路线如下(部分反应略去试剂和条件):
已知:
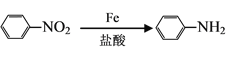
(1)烃A的结构简式是__________,G中的官能团名称是__________。
(2)反应①的反应条件是_________,反应⑥的反应类型是__________。
(3)下列对抗结肠炎药物有效成分M可能具有的性质推测正确的是________(填字母)。
A.既有酸性又有碱性 B.能发生消去反应
C.能发生加聚反应 D.1mol M与足量溴水充分反应,最多消耗1molBr2
(4)E与足量NaOH溶液反应的化学方程式是_______________________。
(5)写出符合下列条件的D的同分异构体的结构简式(任写一种)__________。
①属于芳香族化合物且苯环上有3个取代基
②能和NaHCO3溶液反应产生气体
③核磁共振氢谱有4组峰且峰面积之比为6∶2∶1∶1
(6)M在一定条件下可以发生缩聚反应生成含肽键的高分子化合物,写出该反应的化学方程式:_______________________________________________________
(7)已知:①![]() 易被氧化,②苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位。③苯环上连有羧基时再引入一个取代基,常取代在羧基的间位。参照以上的合成路线,设计一条以A为原料合成化合物
易被氧化,②苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位。③苯环上连有羧基时再引入一个取代基,常取代在羧基的间位。参照以上的合成路线,设计一条以A为原料合成化合物![]() 的合成路线。_______
的合成路线。_______
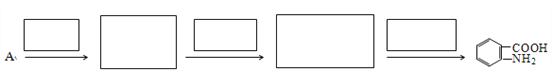
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是几种原子的基态电子排布,电负性最大的原子是
A. 1s22s22p4 B. 1s22s22p63s23p3 C. 1s22s22p63s23p2 D. 1s22s22p63s23p64s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学需要配制450 mL 0.5 mol·L-1的NaOH溶液。请回答下列问题:
(1)在实验过程中用到的玻璃仪器有:玻璃棒、量筒、烧杯、______________、胶头滴管、试剂瓶。
(2)用托盘天平称量时,应将NaOH放在________称量,称取的固体质量为_______。
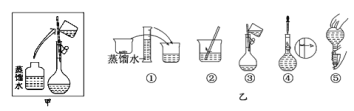
(3)配制时操作步骤如乙图所示,则甲图操作应在乙图中的___(填选项字母)之间。
A.①与② B.②与③ C.③与④ D.④与⑤
(4)配制过程中洗涤烧杯、玻璃棒2~3次的目的是______________________。
(5)定容滴加蒸馏水时,若不慎超过了刻度线,则处理的方法是______________。
(6)该同学实际配制NaOH溶液的浓度为0.6 mol·L-1,原因可能是____(填序号)。
a.砝码上有杂质
b.洗净的容量瓶中残留有少量水
c.称量NaOH固体时,采用了“左码右物”
d.定容时俯视刻度线
e.定容摇匀后发现液面低于刻度线又加入少许水调至刻度线
f.溶解固体的烧杯移液后未洗涤
g.定容前溶液未进行冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平下列方程式
①___FeCl3 +___KI===____FeCl2+____KCl+_____I2
②____ClO-+_____Fe(OH)3+_____OH-===_____Cl-+____FeO![]() +____H2O
+____H2O
(2)用浓硫酸配制稀硫酸的过程中,下列操作会使配制的稀硫酸溶液浓度偏高的是___(填序号)。
①量取浓硫酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液并定容
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com