
【题目】如图所示,装置Ⅰ为新型电池,放电时B电极的反应式为NaBr3+2Na++2e-===3NaBr,装置Ⅱ为铅蓄电池。首先闭合K1和K2,当铅蓄电池充电结束后,断开K1,闭合K2。下列说法正确的是( )
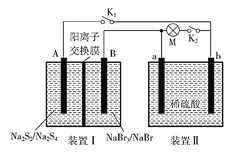
A. 闭合K1、K2时,每有0.1 mol Na+通过离子交换膜,装置II溶液中有0.1mol电子转移
B. 装置Ⅰ放电时的A电极反应式为2Na2S2-2e-===Na2S4+2Na+
C. 断开K1、闭合K2时,b电极的电极反应式为PbO2+2e-+SO42-+4H+===PbSO4+2H2O
D. 断开K1、闭合K2时,装置Ⅱ中SO42-向a电极迁移
 核心素养学练评系列答案
核心素养学练评系列答案科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水中氯化物的含量相当高,主要是氯化钠,其次是氯化镁、氯化钙和氯化钾等。从海水中提取食盐和溴的过程如下:
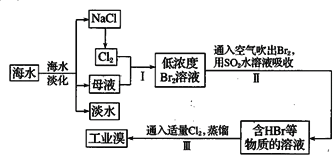
(1)氯原子的结构示意图为____________________。
(2)用NaCl为原料生产氯气的化学方程式为___________________________________。
(3)步骤Ⅱ中用热空气就可以把Br2吹出来的原因是_____________________________。
(4)步骤Ⅱ中用SO2水溶液吸收Br2,可制得HBr和硫酸,试写出该反应的化学方程式_________________________________________________。
(5)步骤Ⅲ用氯气提取溴,这是利用了氯气的__________性。(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成抗肿瘤药物吉非替尼的一种中间体,可通过以下方法合成:
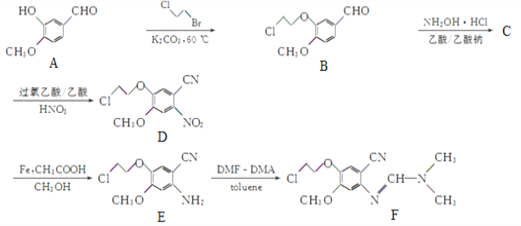
(1)化合物D中含氧官能团的名称为______和______。
(2)D→E的反应类型为______。
(3)化合物C的分子式为C10H10O2NCl,写出C的结构简式:______。
(4)写出满足下列条件的B的一种同分异构体的结构简式:______。
①能发生水解反应,其中一种产物能与FeCl3溶液发生显色反应;
②分子中有三种不同化学环境的氢。
(5)已知:① ;
;
②R1-CHO+R2-NH2![]() R1-CH=N-R2。
R1-CH=N-R2。
请以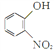 与ClCH2CH2Br为原料制备
与ClCH2CH2Br为原料制备![]() ,写出相应的合成路线图(无机试剂任选,合成路线流程图示例见本题题干)_________。
,写出相应的合成路线图(无机试剂任选,合成路线流程图示例见本题题干)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有下列电子排布式的原子中,半径最大的是( )
A. 1s22s22p63s23p5 B. 1s22s22p3
C. 1s22s22p2 D. 1s22s22p63s23p4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是( )
A. 将CH3COONa溶液从20℃升温至30℃,溶液中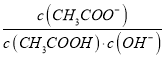 增大
增大
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C. 0.2 mol/L HCOOH 与 0.1 mol/L NaOH 等体积混合后:c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol/L CH3COONa 与 0.1 mol/L盐酸等体积混合后 (pH<7):c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制0.5 mol/L的NaOH溶液500 mL:
(1)主要操作步骤的正确顺序是__________________________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;②用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;③待冷却至室温后,将溶液转移到500mL容量瓶中;④盖好瓶塞,反复上下颠倒,摇匀;⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________________________,烧杯的实际质量为_______________克。

(3)使用容量瓶前必须进行的一步操作是__________________________________。
(4)在配制过程中,其他操作都正确的,下列操作会引起误差偏高的是_______________
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视标线
⑤定容时仰视标线
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是几种原子的基态电子排布,电负性最大的原子是
A. 1s22s22p4 B. 1s22s22p63s23p3 C. 1s22s22p63s23p2 D. 1s22s22p63s23p64s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗结肠炎药物有效成分M的合成路线如下(部分反应略去试剂和条件)

已知:①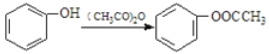 ②
②
(1)烃A的名称是_________________,G中的官能团名称是_______________________。
(2)反应①的反应条件是__________________,反应②的反应类型是_____________________。
(3) E与足量NaOH溶液反应的化学方程式是______________________________________。
(4)符合下列条件的D的同分异构体有_______种。其中核磁共振氢谱有4组峰且峰面积之比为6:2:1:1的结构简式是_____________________。(写出一种即可)
①属于芳香族化合物且苯环上有3个取代基
②能和NaHCO3溶液反应产生气体
(5)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A 为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A 为原料合成化合物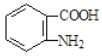 的合成路线_______________
的合成路线_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com