
ЁОЬтФПЁПЛЏКЯЮяFЪЧКЯГЩвЛжжЬьШЛЦРрЛЏКЯЮяЕФживЊжаМфЬхЃЌЦфКЯГЩТЗЯпШчЯТЃК
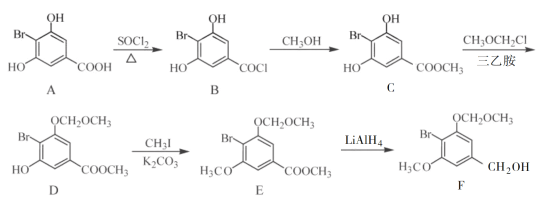
ЃЈ1ЃЉEжаКЌбѕЙйФмЭХЕФУћГЦЮЊ________КЭ________ЁЃ
ЃЈ2ЃЉBЁњCЕФЗДгІРраЭЮЊ________ЁЃ
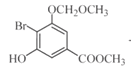
ЃЈ3ЃЉCЁњDЗДгІжаЛсгаИБВњЮяXЃЈЗжзгЪНЮЊC12H15O6BrЃЉЩњГЩЃЌXЕФНсЙЙМђЪНЮЊЃК________ЁЃЗДгІDЁњEЕФЗНГЬЪНЮЊ______________ЁЃ
ЃЈ4ЃЉCЕФвЛжжЭЌЗжвьЙЙЬхЭЌЪБТњзуЯТСаЬѕМўЃЌаДГіИУЭЌЗжвьЙЙЬхЕФНсЙЙМђЪНЃК________ЁЃ
ЂйФмгыFeCl3ШмвКЗЂЩњЯдЩЋЗДгІЃЛ
ЂкМюадЫЎНтКѓЫсЛЏЃЌКЌБНЛЗЕФВњЮяЗжзгжаВЛЭЌЛЏбЇЛЗОГЕФЧтдзгЪ§ФПБШЮЊ1ЁУ1ЁЃ
ЃЈ5ЃЉвбжЊЃК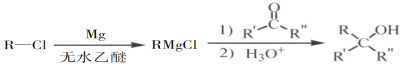 ЃЈRБэЪОЬўЛљЃЌR'КЭR"БэЪОЬўЛљЛђЧтЃЉЃЌаДГівд
ЃЈRБэЪОЬўЛљЃЌR'КЭR"БэЪОЬўЛљЛђЧтЃЉЃЌаДГівд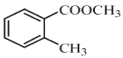 КЭCH3CH2CH2OHЮЊдСЯжЦБИЕФ
КЭCH3CH2CH2OHЮЊдСЯжЦБИЕФ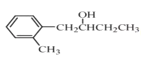 КЯГЩТЗЯпСїГЬЭМЃЈЮоЛњЪдМСКЭгаЛњШмМСШЮгУЃЌКЯГЩТЗЯпСїГЬЭМЪОР§МћБОЬтЬтИЩЃЉЁЃ____________________
КЯГЩТЗЯпСїГЬЭМЃЈЮоЛњЪдМСКЭгаЛњШмМСШЮгУЃЌКЯГЩТЗЯпСїГЬЭМЪОР§МћБОЬтЬтИЩЃЉЁЃ____________________
ЁОД№АИЁПѕЅЛљ УбМќ ШЁДњЗДгІ 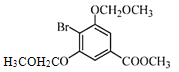
 +CH3IЁњ
+CH3IЁњ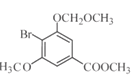 +HI
+HI 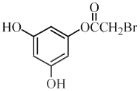
ЁОНтЮіЁП
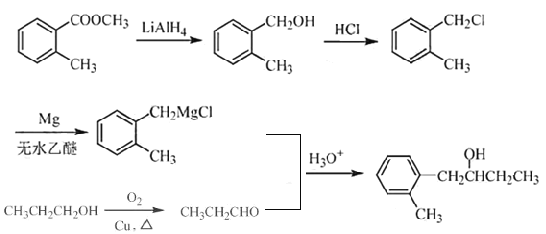
ЃЈ1ЃЉИљОнЬтжаEЕФНсЙЙМђЪНПЩЭЦжЊEжаКЌбѕЙйФмЭХЃЛ
ЃЈ2ЃЉИљОнЬтжааХЯЂПЩжЊПЩЭЦжЊBЁњCЕФЗДгІРраЭЃЛ
ЃЈ3ЃЉИљОнТЗЯпЭМПЩжЊЃЌC зЊЛЏЮЊDЃЌЪЧC жавЛИієЧЛљжаЕФЧтЃЌБЛ-CH2OCH3ШЁДњЃЌЖјCЗжзгжаКЌгаСНИієЧЛљЃЌЭЦВтСэвЛИієЧЛљвВПЩвдЗЂЩњДЫЗДгІЃЌНсКЯИБВњЮяXЕФЗжзгЪНЮЊC12H15O6BrЃЌПЩЭЦЖЯГіXЕФНсЙЙМђЪНЃЛИљОнСїГЬПЩжЊЃЌЗДгІDЁњEЕФЗДгІЮЊШЁДњЗДгІЃЌОнДЫаДГіЗДгІЕФЗНГЬЪНЃЛ
ЃЈ4ЃЉИУЭЌЗжвьЙЙЬхПЩвдгыFeCl3ШмвКЗЂЩњЯдЩЋЗДгІЃЌдђИУЭЌЗжвьЙЙЬхжаКЌгаЗгєЧЛљЃЌгжвђЮЊЦфМюадЫЎНтКѓЫсЛЏЃЌКЌБНЛЗЕФВњЮяЗжзгжаВЛЭЌЛЏбЇЛЗОГЕФЧтдзгЪ§ФПБШЮЊ1ЁУ1ЃЌОнДЫПЩЭЦЖЯЦфНсЙЙМђЪНЃЛ
ЃЈ5ЃЉИљОнТЗЯпЭМКЭвбжЊжаЬсЙЉЕФЗДгІЃЌНсКЯ КЭ
КЭ![]() СНжждСЯЩшМЦжЦБИ
СНжждСЯЩшМЦжЦБИ ЕФТЗЯпЁЃ
ЕФТЗЯпЁЃ
ЃЈ1ЃЉИљОнЬтжаEЕФНсЙЙМђЪНПЩжЊЃЌEжаКЌбѕЙйФмЭХЮЊѕЅЛљЁЂУбМќЃЛ
ЙЪД№АИЪЧЃКѕЅЛљЁЂУбМќЃЛ
ЃЈ2ЃЉИљОнЬтжааХЯЂПЩжЊЃЌгаЛњЮяBЕФНсЙЙжа-COClБфЮЊгаЛњЮяCжаЕФ-COOCH3ЃЌCH3O-ШЁДњСЫClЃЌЫљвдBЁњCЕФЗДгІРраЭЮЊШЁДњЗДгІЃЛ
ЙЪД№АИЪЧЃКШЁДњЗДгІЃЛ
ЃЈ3ЃЉИљОнТЗЯпЭМПЩжЊЃЌC зЊЛЏЮЊDЃЌЪЧC жавЛИієЧЛљжаЕФЧтЃЌБЛ-CH2OCH3ШЁДњЃЌЖјCЗжзгжаКЌгаСНИієЧЛљЃЌЭЦВтСэвЛИієЧЛљвВПЩвдЗЂЩњДЫЗДгІЃЌНсКЯИБВњЮяXЕФЗжзгЪНЮЊC12H15O6BrЃЌПЩЭЦЖЯГіXЕФНсЙЙМђЪНЮЊ ЃЛИљОнСїГЬПЩжЊЃЌDЁњEЕФЗДгІЮЊШЁДњЗДгІЃЌЗДгІЕФЗНГЬЪНЮЊЃК
ЃЛИљОнСїГЬПЩжЊЃЌDЁњEЕФЗДгІЮЊШЁДњЗДгІЃЌЗДгІЕФЗНГЬЪНЮЊЃК +CH3IЁњ
+CH3IЁњ +HIЃЛ
+HIЃЛ
ЙЪД№АИЪЧЃК ЃЛ
ЃЛ +CH3IЁњ
+CH3IЁњ +HIЃЛ
+HIЃЛ
ЃЈ4ЃЉИУЭЌЗжвьЙЙЬхПЩвдгыFeCl3ШмвКЗЂЩњЯдЩЋЗДгІЃЌдђИУЭЌЗжвьЙЙЬхжаКЌгаЗгєЧЛљЃЌгжвђЮЊЦфМюадЫЎНтКѓЫсЛЏЃЌКЌБНЛЗЕФВњЮяЗжзгжаВЛЭЌЛЏбЇЛЗОГЕФЧтдзгЪ§ФПБШЮЊ1ЁУ1ЃЌПЩЭЦЖЯЦфНсЙЙМђЪНЮЊ ЃЛ
ЃЛ
ЙЪД№АИЪЧЃК ЃЛ
ЃЛ
ЃЈ5ЃЉИљОнТЗЯпЭМКЭвбжЊжаЬсЙЉЕФЗДгІЃЌвд КЭ
КЭ![]() ЮЊдСЯжЦБИ
ЮЊдСЯжЦБИ ЕФТЗЯпЮЊЃК
ЕФТЗЯпЮЊЃК ЃЛ
ЃЛ
ЙЪД№АИЪЧЃК ЁЃ
ЁЃ


 ПкЫуЬтПЈББОЉИОХЎЖљЭЏГіАцЩчЯЕСаД№АИ
ПкЫуЬтПЈББОЉИОХЎЖљЭЏГіАцЩчЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЖдЯрЙиЪЕбщЕФа№ЪіЗћКЯЪТЪЕЕФЪЧ
A.ЬњгыЫЎеєЦјдкИпЮТЯТЕФЗДгІВњЮяЮЊFe3O4КЭH2
B.ЯђвЛаЁЩеБжаЗжБ№МгШыЕШЬхЛ§ЕФЫЎКЭУКгЭЃЌЦЌПЬКѓдйЯђИУЩеБжаЛКТ§ЕиМгШывЛТЬЖЙСЃДѓЕФН№ЪєФЦЃЌПЩФмЙлВьЕНЕФЯжЯѓЪЧШчЭМ

C.гУНрОЛЕФВЌЫПеКШЁД§ВтвКЃЌжУгкОЦОЋЕЦЛ№бцЩЯзЦЩеЃЌЙлВьЕНЛ№бцГЪЛЦЩЋЃЌдђБэУїД§ВтвКжавЛЖЈКЌгаNa+ЖјВЛКЌK+
D.гУлсліЧЏМазЁТСВдкОЦОЋЕЦЩЯМгШШжСШлЛЏЃЌЧсЧсЛЮЖЏЃЌгавКЬЌЕФТСЕЮТфЯТРД
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСажИЖЈЗДгІЕФРызгЗНГЬЪНе§ШЗЕФЪЧ
A.ЯђFeBr2ШмвКжаЭЈШыЩйСПCl2ЃК2BrЃ+ Cl2 = Br2+ 2ClЃ
B.ЯђNH4Al(SO4)2ШмвКжаМгШыЙ§СПKOHШмвКЃКAl3+ + 4OH- = AlO2- + 2H2O
C.гУЧтбѕЛЏФЦШмвКЮќЪеЙЄвЕЗЯЦјжаЕФNO2ЃК2NO2 + 2OH- = NO3- + NO2- + H2O
D.гУЖшадЕчМЋЕчНтAlCl3ШмвКЃК2Cl- + 2H2O ![]() Cl2Ёќ + H2Ёќ + 2OH-
Cl2Ёќ + H2Ёќ + 2OH-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈжае§ШЗЕФЪЧ
A.дкДжЭЕФОЋСЖЙ§ГЬжаЃЌШєЕчТЗжазЊвЦ1 mol ЕчзгЃЌдђбєМЋжЪСПвЛЖЈМѕЩйСЫ32 g
B.ЗДгІ8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) ІЄH<0ЃЌдђИУЗДгІвЛЖЈФмздЗЂНјаа
C.1.2gЕФН№ИеЪЏКЭ12g ЕФSiO2ЗжБ№КЌга0.4molЕФC-CМќгы0.4mol ЕФSi-O Мќ
D.ГЃЮТЯТЃЌЯђNH4ClШмвКжаМгШыЩйСПNaOHЙЬЬхЃЈШмвКЮТЖШУЛгаБфЛЏЃЉЃЌШмвКжа![]() ЕФжЕдіДѓ
ЕФжЕдіДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкЪЕбщЪвжагУЖўбѕЛЏУЬИњХЈбЮЫсЗДгІжЦБИИЩдяДПОЛЕФТШЦјЁЃЫљгУвЧЦїШчЭМЃК
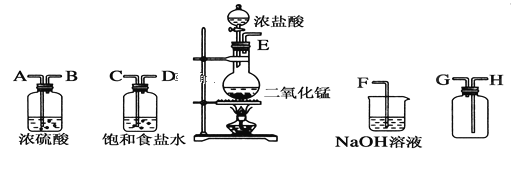
ЃЈ1ЃЉСЌНгЩЯЪівЧЦїЕФе§ШЗЫГађ(ЬюИїНгПкДІЕФзжФИ)ЃК__Нг__ЃЛ__Нг__ЃЛ__Нг__ЃЛ__Нг__ЁЃ
ЃЈ2ЃЉзАжУжаЃЌБЅКЭЪГбЮЫЎЕФзїгУЪЧ______________ЃЛNaOHШмвКЕФзїгУЪЧ____________ЁЃ
ЃЈ3ЃЉЂйЦјЬхЗЂЩњзАжУжаНјааЗДгІЕФЛЏбЇЗНГЬЪНЃК_____________________________ЃЛИУЗНГЬЪНжаЬхЯжХЈбЮЫсЕФ__________________ЁЂ____________________ аджЪЃЛбѕЛЏМСКЭЛЙдМСЕФЮяжЪЕФСПжЎБШЃК________________________________________ЃЛ
ЂкNaOHШмвКжаЗЂЩњЗДгІЕФРызгЗНГЬЪНЃК_______________________________________ЃЛ
ЃЈ4ЃЉЪЕбщЪвгУЯТСаЗНЗЈжЦШЁТШЦјЃКЂйгУКЌ4 mol ТШЛЏЧтЕФХЈбЮЫсгызуСПЕФЖўбѕЛЏУЬЗДгІЃЛЂкгУ87 g ЖўбѕЛЏУЬгызуСПХЈбЮЫсЗДгІЃЌШєВЛПМТЧТШЛЏЧтЕФЛгЗЂЃЌдђЗДгІКѓЫљЕУТШЦјЕФЮяжЪЕФСПЃЈ_____ЃЉ
AЃЎЂйБШЂкЖр BЃЎЂкБШЂйЖр CЃЎСНжжЗНЗЈвЛбљЖр DЃЎЮоЗЈБШНЯ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌЗДгІN2(g)+3H2(g)![]() 2NH3(g)ДяЕНЛЏбЇЦНКтзДЬЌЕФБъжОЪЧ
2NH3(g)ДяЕНЛЏбЇЦНКтзДЬЌЕФБъжОЪЧ
A. c(N2):c(H2):c(NH3)=1:3:2
B. N2ЁЂH2КЭNH3ЕФЮяжЪЕФСПЗжЪ§ВЛдйИФБф
C. N2гыH2ЕФЮяжЪЕФСПжЎКЭЪЧNH3ЕФЮяжЪЕФСПЕФ2БЖ
D. ЕЅЮЛЪБМфРяУПдіМгlmolN2ЃЌЭЌЪБдіМг3molH2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШЁ100.0 mLNa2CO3КЭNa2SO4ЕФЛьКЯШмвКЃЌМгШыЙ§СПBaCl2ШмвККѓЕУЕН16.84gГСЕэЃЌгУЙ§СПЯЁЯѕЫсДІРэКѓГСЕэжЪСПМѕЩйжС6.99g,ЭЌЪБШмвКжагаЦјХнВњЩњЁЃЪдЧѓЃК
ЃЈ1ЃЉдЛьКЯвКжаNa2SO4ЕФЮяжЪЕФСПХЈЖШЮЊ_____ЃЛ
ЃЈ2ЃЉВњЩњЕФЦјЬхдкБъзМзДПіЯТЕФЬхЛ§ЮЊЖрЩй__________ЃПЃЈвЊЧѓаДГіМЦЫуЙ§ГЬЃЌжЛаДНсЙћВЛИјЗжЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкаТжЦТШЫЎЕФа№Ъіе§ШЗЕФЪЧ( )
A.ЙтееаТжЦТШЫЎгаЦјХнвнГіЃЌИУЦјЬхЪЧCl2B.аТжЦТШЫЎЗХжУЪ§ЬьКѓЫсадМѕШѕ
C.аТжЦТШЫЎжажЛКЌгаCl2КЭH2OСНжжЗжзгD.аТжЦТШЫЎПЩЪЙРЖЩЋЪЏШяЪджНЯШБфКьКѓЭЪЩЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯђ20.00mL 0.200 0 mol/LNH4ClШмвКжаж№ЕЮМгШы0.2000 mol/LNaOHШмвКЪБЃЌШмвКЕФpHгыЫљМгNaOHШмвКЬхЛ§ЕФЙиЯЕШчЯТЭМЫљЪОЃЈВЛПМТЧЛгЗЂЃЉЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
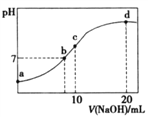
A. aЕуШмвКжаЃКc(H+)+c(NH3ЁЄH2O)=c(OH-)+c(NH4+)
B. bЕуШмвКжаЃКc(Cl-)=c(Na+)>c(H+)=c(OH-)
C. cЕуШмвКжаЃКc(NH3ЁЄH2O)+ c(NH4+)= c(Cl-)+ c(OH-)
D. dЕуШмвКжаЃКc(Cl-)> c(NH3ЁЄH2O)> c(OH-)> c(NH4+)
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com