
【题目】下列指定反应的离子方程式正确的是
A.向FeBr2溶液中通入少量Cl2:2Br-+ Cl2 = Br2+ 2Cl-
B.向NH4Al(SO4)2溶液中加入过量KOH溶液:Al3+ + 4OH- = AlO2- + 2H2O
C.用氢氧化钠溶液吸收工业废气中的NO2:2NO2 + 2OH- = NO3- + NO2- + H2O
D.用惰性电极电解AlCl3溶液:2Cl- + 2H2O ![]() Cl2↑ + H2↑ + 2OH-
Cl2↑ + H2↑ + 2OH-
【答案】C
【解析】
A.还原性:Fe2+>Br-,所以向FeBr2溶液中通入少量Cl2,亚铁离子被氧化,离子方程式为: 2Fe2++ Cl2 =2Fe3++ 2Cl-,故A错误;
B.氢氧化铝溶于强碱溶液;向NH4Al(SO4)2溶液中加入过量NaOH溶液,反应的离子方程式为:Al3++ NH4++5OH-=AlO2-+2H2O+ NH3H2O,选项B错误;
C.用氢氧化钠溶液吸收工业废气中的NO2,反应的离子方程式为:2NO2+2OH-=NO3-+NO2-+H2O,选项C正确;
D.用惰性电极电解AlCl3溶液,反应的离子方程式为:2Al3++6Cl-+6H2O![]() 3Cl2↑+3H2↑+2Al(OH)3↓,选项D错误;
3Cl2↑+3H2↑+2Al(OH)3↓,选项D错误;
故答案选C。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)设计简单实验证明CH3COOH为弱酸__。
(2)向0.1mol/L CH3COOH溶液中加蒸馏水稀释至100mL,在稀释过程中,下列量的变化是(“增大”、“减小”、“不变”或“不能确定”):
n(H+)=___,![]() =___,
=___,![]() =__,c(OH-)=___。
=__,c(OH-)=___。
(3)OH-浓度相同的等体积的两份溶液:盐酸和CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是__(填写序号)
①反应需要的时间:CH3COOH>HCl
②开始反应的速率:HCl>CH3COOH
③参加反应的锌粉的物质的量:CH3COOH=HCl
④反应过程的平均速率:CH3COOH>HCl
⑤盐酸中有锌粉剩余
⑥CH3COOH溶液中有锌粉剩余
(4)向饱和食盐水中滴加一定浓度的盐酸,对出现现象的预测可能正确的是__。
A.白色沉淀 B.液体分层 C.无明显现象 D.黄绿色气体
(5)现有下列溶液:①纯水;②pH=10的NaOH溶液;③pH=3的醋酸溶液;④pH=10的CH3COONa溶液。试比较四种溶液中水的电离程度的大小关系__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:
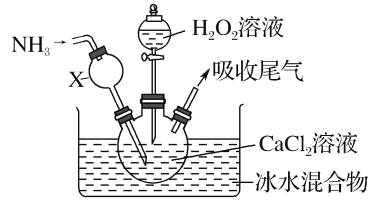
回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有___。
(2)仪器X的主要作用除导气外,还具有的作用是___。
(3)在冰水浴中进行的原因是___。
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为___。
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是____。
A.无水乙醇 B.浓盐酸 C.Na2SO3溶液 D.CaCl2溶液
(6)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
①Fe3+ +H2O2=Fe2++H++HOO·
②H2O2+X=Y +Z+W(已配平)
③Fe2++·OH=Fe3++OH-
④H+ +OH-=H2O
根据上述机理推导步骤②中的化学方程式为___。
(7)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有____的性质。
A.与水缓慢反应供氧 B.能吸收鱼苗呼出的CO2气体
C.能是水体酸性增强 D.具有强氧化性,可杀菌灭藻
(8)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。
该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。
则:所得过氧化钙样品中CaO2的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质不能实现直接转化的是( )
A.C→CO2→NaHCO3→Na2CO3
B.Al→Al(OH)3→Al2O3→NaAlO2
C.Na→NaOH→Na2CO3→NaHCO3
D.Na→Na2O2→Na2CO3→NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)Fe2(SO4)3(写出电离方程式)_____
(2)铝和氢氧化钠溶液混合(写出反应的离子方程式)_____
(3)2H++CO32﹣═H2O+CO2↑(改写成化学方程式)________
(4)除去NaHCO3溶液中混有少量 Na2CO3溶液的离子反应方程式_____.
Ⅱ.有一瓶溶液只含Cl﹣、CO32﹣、SO42﹣、Na+、Mg2+、Cu2+六种离子中的某几种通过实验:
①原溶液![]() 白色沉淀;
白色沉淀;
②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解.
(1)试分析原溶液中一定含有的离子是_____,一定不含有的离子是_____,
(2)有的同学认为实验③可以省略,你认为是否正确_____(填是或否),理由是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.中性溶液中:Fe3+、NH4+、Br、HCO3-
B.澄清透明的溶液中:Na+、Cu2+、NO3-、Cl-
C.c(OH-)<![]() 的溶液中:Na+、Ca2+、ClO-、F-
的溶液中:Na+、Ca2+、ClO-、F-
D.1mo/L的KNO3溶液中:H+、Fe2+、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe3+、NH![]() 、Cl-、CO
、Cl-、CO![]() 和SO
和SO![]() 。现每次取10.00 mL进行实验:
。现每次取10.00 mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体0.672 L (标准状况下);
③第三份加足量BaCl2溶液后得干燥沉淀6.63 g,沉淀经足量盐酸洗涤,干燥后剩4.66 g。
请回答:
(1) c(CO![]() )=____mol·L-1。
)=____mol·L-1。
(2) K+是否存在?_______;若存在,浓度范围是_____(若不存在,则不必回答)。
(3) 根据以上实验:
①不能判断哪些离子是否存在________________;
②若存在这些离子,如何进行检验?_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:
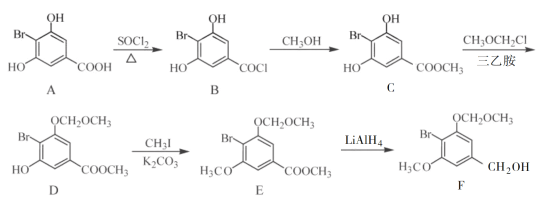
(1)E中含氧官能团的名称为________和________。
(2)B→C的反应类型为________。
(3)C→D反应中会有副产物X(分子式为C12H15O6Br)生成,X的结构简式为:________。反应D→E的方程式为______________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(5)已知: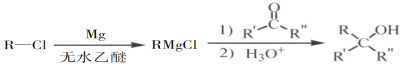 (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以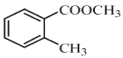 和CH3CH2CH2OH为原料制备的
和CH3CH2CH2OH为原料制备的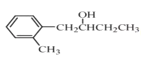 合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。____________________
合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室经常用KMnO4与过量浓盐酸反应制备氯气,化学方程式如下:2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O。
(1)用单线桥标出电子转移的方向和数目:__________。
(2)将此反应改写为离子方程式:___________________。
(3)若31.6g KMnO4与过量浓盐酸充分反应,被氧化的HCl的物质的量为_____,在标准状况下生成的Cl 2的体积为____。
(4)用生成的氯气通入下面的装置来验证氯气的某些性质。
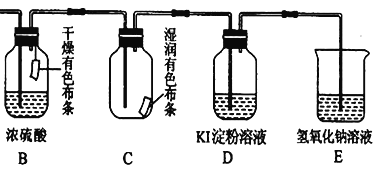
用离子方程式解释C中有色布条褪色的原因:______________,将B、C的顺序颠倒,可否达到原来的实验目的:______(填“可以”或“不可以”);D是用来检验氯气性质的实验,可观察到溶液由无色变为蓝色(I2单质遇淀粉变蓝色),请比较Cl2、I2 、KMnO4 的氧化性,由强到弱为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com