
ΓΨΧβΡΩΓΩΫϋΡξΈ“Ιζ¥σΝΠΦ”«ΩΈ¬ “ΤχΧεCO2¥ΏΜ·«βΜ·Κœ≥…ΦΉ¥ΦΦΦ θΒΡΙΛ“ΒΜ·ΝΩ≤ζ―–ΨΩΘ§ Βœ÷Ω…≥÷–χΖΔ’ΙΓΘ
(1)“―÷ΣΘΚCO2(g)+H2(g) H2O(g) +CO(g) ΠΛH1 = + 41.1 kJmol-1
CO(g)+2H2(g) CH3OH(g) ΠΛH2=Θ≠90.0 kJmol-1
–¥≥ωCO2¥ΏΜ·«βΜ·Κœ≥…ΦΉ¥ΦΒΡ»»Μ·―ßΖΫ≥Χ ΫΘΚ___________________________________________ΓΘ
(2)ΈΣΧαΗΏCH3OH≤ζ¬ Θ§άμ¬έ…œ”Π≤…”ΟΒΡΧθΦΰ «_______Θ®ΧνΉ÷ΡΗΘ©ΓΘ
aΘ°ΗΏΈ¬ΗΏ―Ι bΘ°ΒΆΈ¬ΒΆ―Ι cΘ°ΗΏΈ¬ΒΆ―Ι dΘ°ΒΆΈ¬ΗΏ―Ι
(3)250ΓφΓΔ‘ΎΚψ»ίΟή±’»ίΤς÷–”…CO2(g)¥ΏΜ·«βΜ·Κœ≥…CH3OH(g)Θ§œ¬ΆΦΈΣ≤ΜΆ§ΆΕΝœ±»[n(H2)/n(CO2)] ±Ρ≥Ζ¥”ΠΈοXΤΫΚβΉΣΜ·¬ ±δΜ·«ζœΏΓΘ
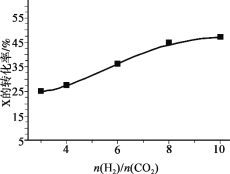
Ζ¥”ΠΈοX «_______Θ®ΧνΓΑCO2Γ±ΜρΓΑH2Γ±Θ©ΓΘ
(4)250ΓφΓΔ‘ΎΧεΜΐΈΣ2.0LΒΡΚψ»ίΟή±’»ίΤς÷–Φ”»κ6mol H2ΓΔ2mol CO2ΚΆ¥ΏΜ·ΦΝΘ§10min ±Ζ¥”Π¥οΒΫΤΫΚβΘ§≤βΒΟc(CH3OH) = 0.75 molΓΛ LΘ≠1ΓΘ
ΔΌΜ·―ßΤΫΚβ≥Θ ΐK = _______ΓΘ
ΔΎ¥ΏΜ·ΦΝΚΆΖ¥”ΠΧθΦΰ”κΖ¥”ΠΈοΉΣΜ·¬ ΚΆ≤ζΈοΒΡ―Γ‘ώ–‘”–ΗΏΕ»œύΙΊΓΘΩΊ÷ΤœύΆ§ΆΕΝœ±»ΚΆœύΆ§Ζ¥”Π ±ΦδΘ§ΥΡΉι Β―ι ΐΨί»γœ¬ΘΚ
Β―ι±ύΚ≈ | Έ¬Ε»Θ®KΘ© | ¥ΏΜ·ΦΝ | CO2ΉΣΜ·¬ Θ®%Θ© | ΦΉ¥Φ―Γ‘ώ–‘Θ®%Θ© |
A | 543 | Cu/ZnOΡ…ΟΉΑτ | 12.3 | 42.3 |
B | 543 | Cu/ZnOΡ…ΟΉΤ§ | 11.9 | 72.7 |
C | 553 | Cu/ZnOΡ…ΟΉΑτ | 15.3 | 39.1 |
D | 553 | Cu/ZnOΡ…ΟΉΤ§ | 12.0 | 70.6 |
ΗυΨί…œ±μΥυΗχ ΐΨίΘ§”ΟCO2…ζ≤ζΦΉ¥ΦΒΡΉν”≈―ΓœνΈΣ_______Θ®ΧνΉ÷ΡΗΘ©ΓΘ
ΓΨ¥πΑΗΓΩ3H2 (g)+CO2 (g) ![]() CH3OH(g)+H2O(g) ΠΛH=Θ≠48.9 kJ/mol d CO2 5.33 B
CH3OH(g)+H2O(g) ΠΛH=Θ≠48.9 kJ/mol d CO2 5.33 B
ΓΨΫβΈωΓΩ
Θ®1Θ©ΗυΨί“―÷Σ»»Μ·―ßΖΫ≥Χ ΫΘ§άϊ”ΟΗ«ΥΙΕ®¬…Ϋχ––Ζ÷ΈωΘ§ΫΪΔΌ+ΔΎΩ…ΒΟCO2¥ΏΜ·«βΜ·Κœ≥…ΦΉ¥ΦΒΡ»»Μ·―ßΖΫ≥Χ ΫΘ§≤ΔΨί¥ΥΦΤΥψλ ±δΘΜ
Θ®2Θ©”–άϊ”ΎΧαΗΏCH3OHΤΫΚβΉΣΜ·¬ Θ§–η“Σ ΙΤΫΚβœρΉ≈’ΐœρ“ΤΕ·Θ§ΫαΚœΤΫΚβ“ΤΕ·‘≠άμΖ÷ΈωΘΜ
Θ®3Θ©ΗυΨίΆ§“ΜΖ¥”ΠΘ§‘ωΦ”Τδ÷–“Μ÷÷Ζ¥”ΠΈοΒΡ≈®Ε»Θ§ΡήΧαΗΏΝμ“Μ÷÷Ζ¥”ΠΈοΒΡΉΣΜ·¬ Θ§ΫαΚœΆΦ ΨΚαΉχ±ξ±μ Ψ[n(H2)/n(CO2)]Θ§Ϋχ––Ζ÷ΈωΫβ¥πΘΜ
Θ®4Θ©ΔΌάϊ”Ο»ΐΕΈ ΫΦΤΥψΤΫΚβ ±ΗςΉιΖ÷ΒΡΈο÷ ΒΡΝΩ≈®Ε»Θ§‘ΌΗυΨίΜ·―ßΤΫΚβ≥Θ ΐΈΣ…ζ≥…Έο≈®Ε»Οί÷°Μΐ”κΖ¥”ΠΈο≈®Ε»Οί÷°ΜΐΒΡ±»Θ§ΦΤΥψΤΫΚβ≥Θ ΐΘΜ
ΔΎΖ÷±πΕ‘±»ABΓΔCD Β―ιΘ§Cu/ZnOΡ…ΟΉΤ§¥ΏΜ·ΦΝ ΙΖ¥”ΠΥΌ¬ ‘ωΦ”Θ§ΦΉ¥Φ―Γ‘ώ–‘ΗΏΘ§Ε‘±»BD Β―ιΘ§Έ¬Ε»…ΐΗΏΘ§CO2ΉΣΜ·¬ …ΐΗΏΘ§ΕχΦΉ¥ΦΒΡ―Γ‘ώ–‘»¥ΫΒΒΆΘ§Ψί¥ΥΖ÷ΈωΓΘ
Θ®1Θ©“―÷ΣΘΚΔΌCO2(g)+H2(g) H2O(g) +CO(g) ΠΛH1 = + 41.1 kJmol-1ΘΜ
ΔΎCO(g)+2H2(g) CH3OH(g) ΠΛH2=Θ≠90.0 kJmol-1ΘΜ
άϊ”ΟΗ«ΥΙΕ®¬…Ω…÷ΣΘ§ΫΪΔΌ+ΔΎΩ…ΒΟΘΚCO2(g)+3H2(g)CH3OH(g)+H2O(g)‘ρΓςH=(+41.1kJ/mol)+(90kJ/mol)=48.9kJ/molΘΜ
Ι ¥πΑΗΈΣΘΚCO2(g)+3H2(g)CH3OH(g)+H2O(g) ΓςH=48.9kJ/molΘΜ
Θ®2Θ©CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΓςH=48.9kJ/molΘΜΗΟΖ¥”Π «Ζ¥”Π«ΑΚσΤχΧεΧεΜΐΦθ–ΓΒΡΖ¥”ΠΘ§Φ”―ΙΤΫΚβ’ΐœρ“ΤΕ·Θ§’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘ§ΫΒΈ¬ΤΫΚβ’ΐœρ“ΤΕ·Θ§‘ρΈΣΧαΗΏCH3OHΤΫΚβΉΣΜ·¬ Θ§Φ¥ΤΫΚβ–η’ΐœρ“ΤΕ·Θ§≤…”ΟΒΡΧθΦΰΈΣΒΆΈ¬ΗΏ―ΙΘΜ
Ι ¥πΑΗΈΣΘΚdΘΜ
Θ®3Θ©Ά§“ΜΖ¥”ΠΘ§‘ωΦ”Τδ÷–“Μ÷÷Ζ¥”ΠΈοΒΡ≈®Ε»Θ§ΡήΧαΗΏΝμ“Μ÷÷Ζ¥”ΠΈοΒΡΉΣΜ·¬ Θ§Εχ±Ψ…μΉΣΜ·¬ ΫΒΒΆΘ§ΆΦ ΨΥφΉ≈ΚαΉχ±ξ‘ω¥σ[n(H2)/n(CO2)]Θ§œύΒ±”ΎC(CO2)≤Μ±δ ±Θ§‘ω¥σC(H2)Θ§ΤΫΚβ’ΐœρ“ΤΕ·Θ§ ΙΕΰ―θΜ·ΧΦΒΡΉΣΜ·¬ ‘ω¥σΘ§Εχ«βΤχΒΡΉΣΜ·¬ ΫΒΒΆΘ§Υυ“‘XΈΣCO2ΘΜ
Ι ¥πΑΗΈΣΘΚCO2ΘΜ
Θ®4Θ©ΔΌΗυΨί“―÷Σ–≈œΔΘ§Ω…Ν–≥ω»ΐΕΈ ΫΘΚ
Μ·―ßΤΫΚβ≥Θ ΐ ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ5.33ΘΜ
ΔΎΖ÷±πΕ‘±»ABΓΔCD Β―ιΘ§‘ΎΆ§―υΈ¬Ε»œ¬Θ§Cu/ZnOΡ…ΟΉΤ§¥ΏΜ·ΦΝ ΙΖ¥”ΠΥΌ¬ ‘ωΦ”Θ§ΦΉ¥Φ―Γ‘ώ–‘ΗΏΘ§Υυ“‘―Γ‘ώBDΫχ––±»ΫœΘ§Ά§―υ¥ΏΜ·ΦΝΧθΦΰœ¬Θ§Έ¬Ε»…ΐΗΏΘ§CO2ΉΣΜ·¬ …ΐΗΏΘ§ΕχΦΉ¥ΦΒΡ―Γ‘ώ–‘»¥ΫΒΒΆΘ§Υυ“‘”ΟCO2…ζ≤ζΦΉ¥ΦΒΡΉν”≈―ΓœνΈΣBΘΜ
Ι ¥πΑΗΈΣΘΚBΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣΒγΒΦ¬ ‘Ϋ¥σΒΦΒγΡήΝΠ‘Ϋ«ΩΓΘ≥ΘΈ¬œ¬”Ο0.100 molΓΛL-1NaOH»ή“ΚΖ÷±πΒΈΕ®10.00mL≈®Ε»ΨυΈΣ0.100 molΓΛL-1ΒΡ―ΈΥαΚΆ¥ΉΥα»ή“ΚΘ§≤βΒΟΒΈΕ®Ιΐ≥Χ÷–»ή“ΚΒΡΒγΒΦ¬ »γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «

A. «ζœΏΔΌ¥ζ±μΒΈΕ®―ΈΥαΒΡ«ζœΏ
B. ΒΈΕ®¥ΉΥαΒΡΙΐ≥Χ”ΠΗΟ―Γ‘ώΦΉΜυ≥»ΉςΈΣ÷Η ΨΦΝ
C. aΓΔbΓΔc»ΐΒψ»ή“Κ÷–Υ°ΒΡΒγάκ≥ΧΕ»ΘΚc>a>b
D. bΒψ»ή“Κ÷–ΘΚc(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΫΪ“ΜΕ®ΝΩ¥ΩΨΜΒΡΑ±ΜυΦΉΥαοß÷Ο”ΎΧΊ÷ΤΒΡΟή±’’φΩ’»ίΤς÷–![]() ΦΌ…η»ίΤςΧεΜΐ≤Μ±δΘ§ΙΧΧε ‘―υΧεΜΐΚω¬‘≤ΜΦΤ
ΦΌ…η»ίΤςΧεΜΐ≤Μ±δΘ§ΙΧΧε ‘―υΧεΜΐΚω¬‘≤ΜΦΤ![]() Θ§ ΙΤδ¥οΒΫΖ÷ΫβΤΫΚβΘΚ
Θ§ ΙΤδ¥οΒΫΖ÷ΫβΤΫΚβΘΚ![]() ΓΘ Β―ι≤βΒΟ≤ΜΆ§Έ¬Ε»œ¬ΒΡΤΫΚβ ΐΨίΝ–”Ύœ¬±μΘΚ
ΓΘ Β―ι≤βΒΟ≤ΜΆ§Έ¬Ε»œ¬ΒΡΤΫΚβ ΐΨίΝ–”Ύœ¬±μΘΚ
Έ¬Ε» |
|
|
|
|
|
ΤΫΚβΤχΧεΉή≈®Ε» |
|
|
|
|
|
œ¬Ν–”–ΙΊ–π ω’ΐ»ΖΒΡ «
A.ΗΟΩ…ΡφΖ¥”Π¥οΒΫΤΫΚβΒΡ±ξ÷Ψ÷°“Μ «ΜλΚœΤχΧεΤΫΨυœύΕ‘Ζ÷Ή”÷ ΝΩ≤Μ±δ
B.“ρΗΟΖ¥”Π![]() ΓΔ
ΓΔ![]() Θ§Υυ“‘‘ΎΒΆΈ¬œ¬Ή‘ΖΔΫχ––
Θ§Υυ“‘‘ΎΒΆΈ¬œ¬Ή‘ΖΔΫχ––
C.¥οΒΫΤΫΚβΚσΘ§»τ‘ΎΚψΈ¬œ¬―ΙΥθ»ίΤςΧεΜΐΘ§ΧεœΒ÷–ΤχΧεΒΡ≈®Ε»‘ω¥σ
D.ΗυΨί±μ÷– ΐΨίΘ§ΦΤΥψ![]() ±ΒΡΖ÷ΫβΤΫΚβ≥Θ ΐ‘ΦΈΣ
±ΒΡΖ÷ΫβΤΫΚβ≥Θ ΐ‘ΦΈΣ![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΜΊ¥πΈ ΧβΘΚ
Δώ.≥ΘΈ¬œ¬Θ§CaSΒΡKsp=10Θ≠8Θ§±ΞΚΆ»ή“Κ÷–¥φ‘ΎΤΫΚβΘΚ CaS(s)![]() Ca2ΘΪ(aq)ΘΪS2Θ≠(aq)
Ca2ΘΪ(aq)ΘΪS2Θ≠(aq)
Θ®1Θ©ΔΌΗΟΈ¬Ε»œ¬Θ§ΫΪ10-4mol/L¬»Μ·ΗΤ»ή“Κ”κ2ΓΝ10-4mol/LΝρΜ·ΡΤ»ή“ΚΒ»ΧεΜΐΜλΚœΘ§ΡήΖώ≤ζ…ζ≥ΝΒμΘΩ¥π___ΘΜΈ¬Ε»…ΐΗΏ ±Θ§Ksp__(ΧνΓΑ‘ω¥σΓ±ΓΔΓΑΦθ–ΓΓ±ΜρΓΑ≤Μ±δΓ±œ¬Ά§)ΓΘ
ΔΎΒΈΦ”…ΌΝΩ≈®―ΈΥαΘ§c(Ca2ΘΪ)___Θ§‘≠“ρ «___(”ΟΈΡΉ÷ΚΆάκΉ”ΖΫ≥Χ ΫΥΒΟς)ΓΘ
Θ®2Θ©»τœρCaS–ϋΉ«“Κ÷–Φ”»κCuSO4»ή“ΚΘ§…ζ≥…“Μ÷÷ΚΎ…ΪΙΧΧεΈο÷ Θ§–¥≥ωΗΟΙΐ≥Χ÷–Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ___ΓΘ
Δρ.(“―÷ΣKsp[Fe(OH)3]ΘΫ10Θ≠38)»τ0.01mol/L FeCl3»ή“Κ÷–Θ§»γΙϊ“Σ…ζ≥…Fe(OH)3≥ΝΒμΘ§”ΠΒς’ϊ»ή“ΚpHΘ§ ΙpH___Θ§»τ“Σ ΙΤδ≥ΝΒμΆξ»ΪΘ§pH”Π___ΓΘΘ®Χα ΨΘΚΧν ΐΨί ±Θ§“Σ”–>Θ§<Θ§=Θ©
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬ΫΪ0.1000molΓΛLΘ≠1ΒΡAgNO3±ξΉΦ»ή“ΚΖ÷±πΒΈΦ”ΒΫ20mL≈®Ε»ΨυΈΣ0.1000molΓΛLΘ≠1ΒΡNaClΚΆNaBr»ή“Κ÷–Θ§ΜλΚœ»ή“ΚΒΡpAg [Θ≠lgc(Ag+)]”κΒΈΕ®ΑΌΖ÷ ΐΘ®ΒΈΕ®Υυ”Ο±ξΉΦ»ή“ΚΧεΜΐœύΕ‘”ΎΒΈΕ®÷’Βψ ±Υυ”Ο±ξΉΦ»ή“ΚΧεΜΐΒΡΑΌΖ÷ ΐΘ©ΒΡ±δΜ·ΙΊœΒ»γΆΦΥυ ΨΓΘœ¬Ν––π ω¥μΈσΒΡ «
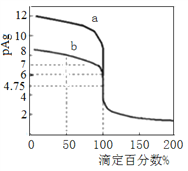
A. «ζœΏa¥ζ±μΒΈΕ®NaBr»ή“Κ
B. Ksp(AgCl) =1ΓΝ10Θ≠9.5
C. ΒΈΕ®÷Ν50% ±Θ§NaCl»ή“Κ÷–c(Na+) ΘΨc(NO3Θ≠)ΘΨc(Ag+)ΘΨc(H+)
D. ΒΈΕ®÷Ν100% ±Θ§c(H+) +c(Ag+) = c(BrΘ≠)+c(OHΘ≠)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΝρΜ·Ι·(HgS)Ρ―»ή”ΎΥ°Θ§‘ΎΉ‘»ΜΫγ÷–≥ ΚλΚ÷…ΪΘ§≥Θ”Ο”Ύ”ΆΜ≠―’ΝœΘ§”ΓΡύΦΑ÷λΚλΒώΩΧΤαΤςΒ»ΓΘΡ≥Έ¬Ε» ±Θ§HgS‘ΎΥ°÷–ΒΡ≥ΝΒμ»ήΫβΤΫΚβ«ζœΏ»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
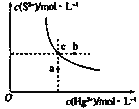
A.œρΝρΜ·Ι·ΒΡΉ«“Κ÷–Φ”»κΝρΜ·ΡΤ»ή“ΚΘ§ΝρΜ·Ι·ΒΡKspΦθ–Γ
B.ΆΦ÷–aΒψΕ‘”ΠΒΡ «±ΞΚΆ»ή“Κ
C.œρcΒψΒΡ»ή“Κ÷–Φ”»κHg(NO3)2Θ§‘ρc(S2-)Φθ–Γ
D.…ΐΗΏΈ¬Ε»Ω…“‘ Βœ÷cΒψΒΫbΒψΒΡΉΣΜ·
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΆΦ Ψ”κΕ‘”ΠΒΡ–π ωœύΖϊΒΡ «
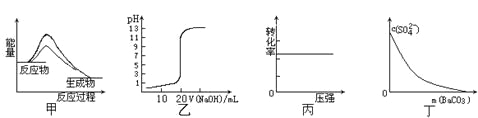
A.ΆΦΦΉ±μ Ψ Ι”Ο¥ΏΜ·ΦΝΚσΘ§ΗΟΖ¥”ΠΒΡΠΛH±δ–Γ
B.ΆΦ““±μ Ψ0Θ°10molΓΛL-1NaOH»ή“ΚΒΈΕ®20Θ°00mL0Θ°10molΓΛL-1CH3COOH»ή“ΚΥυΒΟΒΫΒΡΒΈΕ®«ζœΏ
C.ΆΦ±ϊ±μ ΨΖ¥”ΠH2(g) + I2(g)![]() 2HI(g)÷–H2ΒΡΉΣΜ·¬ Υφ―Ι«ΩΒΡ±δΜ·
2HI(g)÷–H2ΒΡΉΣΜ·¬ Υφ―Ι«ΩΒΡ±δΜ·
D.ΆΦΕΓ±μ Ψ‘Ύ±ΞΚΆNa2SO4»ή“Κ÷–÷π≤ΫΦ”BaCO3ΙΧΧεΚσΘ§»ή“Κ÷–c(SO42-)ΒΡ≈®Ε»±δΜ·
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ “Έ¬œ¬Θ§œρœ¬Ν–»ή“Κ÷–Ά®»κœύ”ΠΒΡΤχΧε÷Ν»ή“ΚpH=7Θ®Ά®»κΤχΧεΕ‘»ή“ΚΧεΜΐΒΡ”ΑœλΩ…Κω¬‘Θ©Θ§»ή“Κ÷–≤ΩΖ÷ΈΔΝΘΒΡΈο÷ ΒΡΝΩ≈®Ε»ΙΊœΒ’ΐ»ΖΒΡ «Θ® Θ©
A. œρ0.10molΓΛLΘ≠1NH4HCO3»ή“Κ÷–Ά®»κCO2ΘΚc(NH4ΘΪ)=c(HCO3Θ≠)ΘΪc(CO32Θ≠)
B. œρ0.10molΓΛLΘ≠1NaHSO3»ή“Κ÷–Ά®»κNH3ΘΚc(NaΘΪ)>c(NH4ΘΪ)>c(SO32Θ≠)
C. 0.10molΓΛLΘ≠1Na2SO3»ή“ΚΆ®»κSO2ΘΚc(NaΘΪ)=2[c(SO32Θ≠)ΘΪc(HSO3Θ≠)ΘΪc(H2SO3)]
D. 0.10molΓΛLΘ≠1CH3COONa»ή“Κ÷–Ά®»κHClΘΚc(NaΘΪ)>c(CH3COOH)=c(ClΘ≠)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ”–Μζ≤ΘΝßΘ® Θ©“ρΨΏ”–ΝΦΚΟΒΡ–‘ΡήΕχΙψΖΚ”Π”Ο”Ύ…ζ≤ζ…ζΜν÷–ΓΘœ¬ΆΦΥυ ΨΝς≥ΧΩ…”Ο”ΎΚœ≥…”–Μζ≤ΘΝßΘ§«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ©“ρΨΏ”–ΝΦΚΟΒΡ–‘ΡήΕχΙψΖΚ”Π”Ο”Ύ…ζ≤ζ…ζΜν÷–ΓΘœ¬ΆΦΥυ ΨΝς≥ΧΩ…”Ο”ΎΚœ≥…”–Μζ≤ΘΝßΘ§«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ

Θ®1Θ©AΒΡΟϊ≥ΤΈΣ_______________ΘΜ
Θ®2Θ©BΓζCΒΡΖ¥”ΠΧθΦΰΈΣ_______________ΘΜDΓζEΒΡΖ¥”Πάύ–ΆΈΣ_______________ΘΜ
Θ®3Θ©ΝΫΗωDΖ÷Ή”ΦδΆ―Υ°…ζ≥…Νυ‘ΣΜΖθΞΘ§ΗΟθΞΒΡΫαΙΙΦρ ΫΈΣ______________ΘΜ
Θ®4Θ©–¥≥ωœ¬Ν–Μ·―ßΖΫ≥Χ ΫΘΚ
GΓζHΘΚ_______________________________ΘΜ
FΓζ”–Μζ≤ΘΝßΘΚ____________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com