
| 化学键 | A-A | B-B | A-B |
| 生成1mol化学键时放出的能量 | 436kJ?mol-1 | 243kJ?mol-1 | 431kJ?mol-1 |
A、
| ||||
| B、A2(g)+B2(g)═2AB(g)△H=-183kJ?mol-1 | ||||
C、
| ||||
| D、2AB(g)═A2(g)+B2(g))△H=+183kJ?mol-1 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水与硫酸发生中和反应 |
| B、氨水能使紫色石蕊试液变蓝 |
| C、0.1 mol/L的NH4Cl溶液的pH值为5.1 |
| D、浓氨水易挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝铵矾[NH4Al(SO4)2?12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
| B、H2O2溶液中滴加酸性KMnO4溶液:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
| C、铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
| D、少量NaHSO4溶液与足量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(B2)=0.08 mol?(L?s)-1 |
| B、v(A2)=0.04 mol?(L?s)-1 |
| C、v(C)=3.6 mol?(L?min)-1 |
| D、v(B2)=5.4 mol?(L?min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
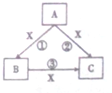 在化学反应中,反应物相同时,因反应条件不同或反应物的量不同产物可能不同,已知A,B,C,X均为中学化学中的常见物质,在常温下它们有如图转化关系(部分产物已略去)回答下列问题
在化学反应中,反应物相同时,因反应条件不同或反应物的量不同产物可能不同,已知A,B,C,X均为中学化学中的常见物质,在常温下它们有如图转化关系(部分产物已略去)回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com