
【题目】室温下将40 g已磨成粉末的Ba(OH)28H2O和20 g NH4Cl置于250 mL锥形瓶中,迅速搅拌将固体药品混合均匀,20 s后用带有玻璃管的单孔橡皮塞塞紧瓶口,玻璃管口悬挂一湿润的红色石蕊试纸,如图所示。试回答:
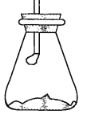
(1)湿润的红色石蕊试纸的变化是________,用化学方程式作出相关解释_______。
(2)若将锥形瓶中的Ba(OH)28H2O和NH4Cl换成__________,也可出现装置内温度降低的现象。
科目:高中化学 来源: 题型:
【题目】取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入苯、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是( )
A.Ⅰ中溶液分层,下层呈紫红色B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色D.Ⅳ中溶液分层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用锌冶炼废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4和Fe2O3的实验流程如下:

已知:“碱浸”时,NaOH溶液浓度越大越粘稠,越容易生成铝硅酸钠沉淀。
(1) “水浸”阶段需在70~80℃条件下进行,适宜的加热方式为________________。
(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②________________。
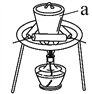
(3)“灼烧”时FeS2发生反应的化学方程式为________________。使用的装置如右图,仪器a的名称为________________。
(4) “碱浸”阶段,在其它条件不变的情况下,所得固体中Fe2O3含量随NaOH溶液的浓度的增大而增大,但当氢氧化钠浓度大于12 mol·L-1时,Fe2O3含量反而降低,其原因是________________。
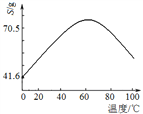
(5)“滤液Ⅰ”溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如右图,请设计从“滤液Ⅰ”中获取ZnSO4晶体的实验方案:________________(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K 时,0.1 mol/L H2R溶液中H2R、HR、R2 三种微粒的分布系数δ随 pH 变化的关系如图所示。已知:298 K时,HF的Ka=1.0×103.4。下列表述正确的是
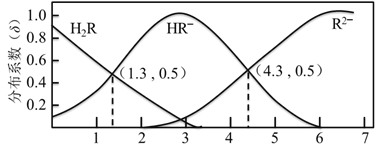
A. H2R的Ka1 = 1.0×101.3
B. Na2R 溶液中离子存在关系:c(Na+) = c(HR ) +2c(R2 )
C. 等物质的量的NaHR 和Na2R溶于水,所得溶液的pH 恰好为4.3
D. 在足量的NaF 溶液中加入少量 H2R 溶液:H2R + 2F = 2HF + R2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关。下列有关说法错误的是
A. 治理雾霾的根本方法是从源头上控制形成雾霾的污染物
B. 沼气属于生物质能,利用生物质能就是间接利用太阳能
C. 食品中的抗氧化剂对人体无害且均有氧化性
D. 从海水中可提取镁,电解熔融氯化镁可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-、CO32-等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示,下列说法错误的是

A.海水pH约为8的原因主要是天然海水含CO32-、HCO3-
B.吸收塔中发生的反应有SO2+H2O![]() H2SO3
H2SO3
C.氧化主要是氧气将HSO3-、SO32-、H2SO3氧化为SO42-
D.经稀释“排放”出的废水中,SO42-浓度与海水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的单质和常见的化合物在工、农业生产中用途广泛。
(1)常用作食品袋中填充气的是_____,常用作制冷剂的化合物是_____,该物质在空气中与HCl相遇有白烟现象,产生该现象的化学反应方程式是_______。
(2)铵盐大多在农业上用作化肥。实验室可用固体NH4Cl与固体Ca(OH)2加热反应来制备氨气,其化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①甲烷的燃烧热为 ΔH=—890.3 kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH=—517.6 kJ/mol
③2CO(g)+O2(g)=2CO2(g) ΔH=—566kJ/mol
甲烷在一定条件下与CO2反应制备合成气(CO、H2),能实现变废为宝,减少CO2的排放,该反应的热化学方程式为_____________________________________________
(2)燃料电池是应用广泛的新型电池,分析下列燃料电池示意图,按要求书写出电极反应式
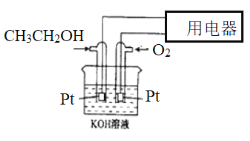
①正极的电极反应式____________________________________________;
②电解质溶液的pH_____________(填“增大”、“减小”或“不变”);
③当电路中转移0.4mol电子时,理论上消耗标准状况下O2的体积为__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:
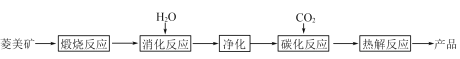
(1)根据下列表格数据,选择消化反应的最佳温度__________;理由是___________________________。
消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________。
(3)流程图中__________和__________可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH为9.5时,此时Mn2+小于__________mol·L-1,不会沉淀出来。
物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________。
A.Ca(ClO)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为__________,理由是______________________。
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com