
【题目】(1)在粗制MgCl2晶体中常含有杂质Fe2+,在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质最好采用的是_________(填下面的选项),加入该氧化剂时,温度不能太高,原因是_________。
A.KMnO4 B.H2O2 C.HNO3 D.氯水
然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,调节溶液pH可选用下列中的有_________。
A.Mg2(OH)2CO3 B.MgO C.NH3·H2O D.Mg(OH)2
某溶液中含Mg2+和Fe3+,c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?_________(FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24)
(2)常温下Ksp[Fe(OH)3]=8.0×1038,Ksp[Cu(OH)2]=3.0×1020,通常认为残留在溶液中的离子浓度小于1×105molL1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL1,为除去溶液中的Fe3+而不影响Cu2+,溶液的pH的范围为_________。(已知lg5=0.7)。
(3)矿物中各种原生铜的硫化物经氧化、淋滤后可变成CuSO4溶液,并向内部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),可慢慢转化为铜蓝(CuS)。写出硫酸铜与ZnS反应的离子方程式为:_________。
【答案】B H2O2受热时会分解 ABD 否 3.3~4 Cu2+(aq)+ZnS(s) CuS(s)+Zn2+(aq)
【解析】
(1)H2O2是绿色氧化剂,不会引入新的杂质且不产生大气污染物,KMnO4、HNO3、氯水都能氧化亚铁离子,但会引入新的杂质或产生大气污染,H2O2受热时会分解,然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,一般加要保留的物质的对应难溶物;某溶液中含Mg2+和Fe3+,先计算Fe3+恰好沉淀完全时溶液中c(PO43) = 1.3×1017,再计算此时Mg3(PO4)2的浓度商,与Ksp[Mg3(PO4)2]相比较。
(2)先计算除去溶液中的Fe3+的氢氧根离子浓度,再算氢离子浓度和pH,再计算Cu2+刚沉淀时的氢氧根离子浓度,再算氢离子浓度和pH。
(3)CuSO4溶液遇到深层的闪锌矿(ZnS)可慢慢转化为铜蓝(CuS)和锌离子。
(1)在粗制MgCl2晶体中常含有杂质Fe2+,在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,H2O2是绿色氧化剂,不会引入新的杂质且不产生大气污染物,KMnO4、HNO3、氯水都能氧化亚铁离子,但会引入新的杂质或产生大气污染,因此最好采用的是B,加入该氧化剂时,由于H2O2受热时会分解,因此使用时温度不能太高,避免降低利用率;然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,一般加要保留的物质的对应难溶物,利用水解原理,铁离子水解生成氢氧化铁和氢离子,氢离子与Mg2(OH)2CO3、MgO、Mg(OH)2反应,促进铁离子水解从而除去,而加入NH3·H2O会引入新的杂质,因此调节溶液pH可选用ABD;某溶液中含Mg2+和Fe3+,c(Mg2+)=0.02 molL1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol/L,Ksp(FePO4) = c(Fe3+)c(PO43) =1.0×105×c(PO43) = 1.3×1022,c(PO43) = 1.3×1017mol/L,此时Mg3(PO4)2浓度商为:c3(Mg2+)c2(PO43) =(0.01)3×(1.3×1017)2= 1.69×1040<1.0×10-24,因此无Mg3(PO4)2沉淀生成;故答案为:B;H2O2受热时会分解;ABD;否。
(2)常温下Ksp[Fe(OH)3]=8.0×1038,Ksp[Cu(OH)2]=3.0×1020,通常认为残留在溶液中的离子浓度小于1×105molL1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL1,为除去溶液中的Fe3+而不影响Cu2+,Ksp[Fe(OH)3]= c(Fe3+)c3(OH-)= 1×105×c3(OH-) = 8.0×1038,c(OH-) =2.0×1011 molL1,![]() ,pH = 4 lg5= 3.3;Ksp[Cu(OH)2]= c(Cu2+)c2(OH-)= 3×c2(OH-) = 3.0×1020,即Cu2+开始沉淀时c(OH-) =1.0×1010 molL1,
,pH = 4 lg5= 3.3;Ksp[Cu(OH)2]= c(Cu2+)c2(OH-)= 3×c2(OH-) = 3.0×1020,即Cu2+开始沉淀时c(OH-) =1.0×1010 molL1,![]() ,pH = 4,因此溶液的pH的范围为3.3~4之间;故答案为:3.3~4。
,pH = 4,因此溶液的pH的范围为3.3~4之间;故答案为:3.3~4。
(3)矿物中各种原生铜的硫化物经氧化、淋滤后可变成CuSO4溶液,并向内部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),可慢慢转化为铜蓝(CuS),则硫酸铜与ZnS反应的离子方程式为:Cu2+(aq)+ZnS(s) CuS(s)+Zn2+(aq);故答案为:Cu2+(aq)+ZnS(s) CuS(s)+Zn2+(aq)。


科目:高中化学 来源: 题型:
【题目】ZrO2是重要的耐温材料,可用作陶瓷遮光剂。天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如下: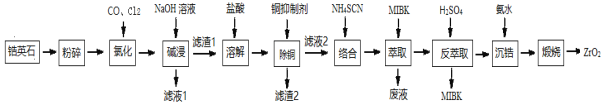
已知:①锆英石中锆元素的化合价为+4 ,“氯化”过程中除C、O元素外,其他元素均转化为最高价氯化物 ②SiCl4极易水解;ZrCl4易溶于水 ③Fe(SCN)3难溶于有机溶剂MIBK; Zr(SCN)4在水中溶解度不大,易溶于有机溶剂MIBK。
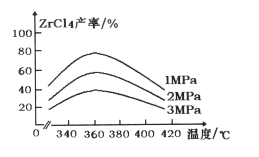
(1) “氯化”过程中,锆英石发生的主要反应的化学方程式为:______________________________,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_____________;
(2)“滤液1”中含有的阴离子除OH- 、Cl-,还有___________________;
(3)常用的铜抑制剂有Na2S、H2S、NaCN等,本流程使用NaCN除铜,不采用Na2S、H2S的原因是__________。
(4)实验室进行萃取和反萃取的玻璃仪器是_______。流程中萃取与反萃取的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组在实验室用如下图所示的装置进行实验,验证氨的某些性质并收集少量纯净的N2。
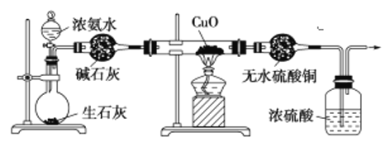
请回答:
(1)实验前先将仪器按图示连接好,然后检查装置的气密性。怎样检查该装置的气密性?________________。
(2)烧瓶内装有生石灰,随浓氨水的滴入,产生氨气。氨气产生的原因是________________。
(3)实验进行一段时间后,观察到加热的硬质玻璃管内的黑色氧化铜粉末变为红色,盛无水CuSO4的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的N2。根据这些现象,写出硬质玻璃管内发生反应的化学方程式:______________________。这个反应说明氨气具有________。
A.碱性 B.还原性 C.氧化性 D.不稳定性
(4)洗气瓶中浓硫酸的主要作用是________________________。
(5)在最后出气管的导管口收集干燥、纯净的氮气,收集方法是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LH2X溶液,溶液的pH与NaOH溶液的体积关系如图所示,下列说法正确的是

A.水电离出来的c(OH):D点<B点
B.C点存在关系式:c(Na+)=c(HX)+2c(X2)c(H+)
C.B点:c(Na+)>c(HX)>c(H+)>c(X2)>cH2X)
D.A点溶液中加入少量水:![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙烯和乙烷的说法中错误的是![]()
![]()
A. 乙烯是平面分子,乙烷分子中所有原子不可能在同一平面内
B. 溴的四氯化碳溶液和酸性![]() 溶液都可以鉴别乙烯和乙烷
溶液都可以鉴别乙烯和乙烷
C. 溴的四氯化碳溶液和酸性![]() 溶液都可以除去乙烷中混有的乙烯
溶液都可以除去乙烷中混有的乙烯
D. 乙烯的化学性质比乙烷的化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某硫酸试剂瓶标签上的部分文字。据此,下列说法正确的是 ( )

A.该硫酸的物质的量浓度为9.2 mol·L-1
B.1 mol Zn与足量的该硫酸反应生成2 g氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2 mol·L-1
D.向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,被还原的硫酸的物质的量小于0.46 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中间体M(2—甲基丙氨酸)的结构简式如图所示。下列有关M的说法错误的是

A.分子式为![]()
B.1molM与NaOH溶液反应,消耗lmolNaOH
C.分子中所有的碳原子不可能处于同一平面
D.与M含有相同官能团的同分异构体有5种![]() 不含本身,不考虑空间异构
不含本身,不考虑空间异构![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)甲烷和氯气在光照条件下发生卤代反应,其反应机理如下:
反应①:![]() △H=242.7kJ·mol-1
△H=242.7kJ·mol-1
反应②:![]() △H=7.5kJ·mol-1
△H=7.5kJ·mol-1
反应③:![]() △H=-112.9kJ·mol-1
△H=-112.9kJ·mol-1
反应②、③反复循环,反应物浓度逐渐降低,自由基逐渐消失,反应停止。
(1)在该反应条件下断裂1mol CH3Cl中C—Cl键,需要吸收的能量为______。
(2)反应②与反应③的反应过程,如下图所示:
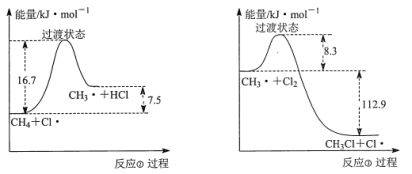
则该条件下,反应②的速率______反应③的速率(填“>”、“<”或“=”)。
(3)根据以上的反应机理,我们可以推测甲烷和氯气在光照条件下反应,除生成CH3Cl、CH2Cl2、CHCl3、CCl4外,还会有乙烷等有机物,原因是______。
(二)煤燃烧排放的SO2和NO2可形成严重的大气污染,某兴趣小组提出利用反应![]() 来处理。
来处理。
(4)在一定温度下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,达到平衡时NO2和SO2的体积之比为1:5,则该温度下平衡常数K为______。
(5)若向绝热恒容密闭容器中通入SO2和NO2,v正随时间变化如下图。下列结论正确的是______。
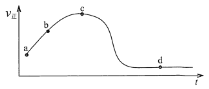
A. a点颜色比b点深
B. c点正反应速率等于逆反应速率
C. 若升高温度,d点SO2的转化率将增大
D. 反应的过程中,容器内气体压强保持不变
E. 若外界条件不发生改变,d点NO2和NO的体积比将保持不变
(6)若用一定浓度的NaClO2溶液(已调节其初始pH为5)充分吸收煤燃烧排放的烟气后,测得溶液中各物质的浓度如下表所示:

其中 NaClO2溶液吸收SO2的主要离子反应方程式为______。
(7)为消除NOx,科学家开发了一种能传导O2-的固态高温陶瓷电池,一极通氨气,另一极通NOx,生成无污染的常见气体和液体。写出该电池的正极反应式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com