
【题目】ZrO2是重要的耐温材料,可用作陶瓷遮光剂。天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如下: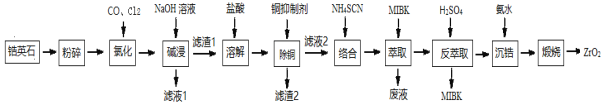
已知:①锆英石中锆元素的化合价为+4 ,“氯化”过程中除C、O元素外,其他元素均转化为最高价氯化物 ②SiCl4极易水解;ZrCl4易溶于水 ③Fe(SCN)3难溶于有机溶剂MIBK; Zr(SCN)4在水中溶解度不大,易溶于有机溶剂MIBK。
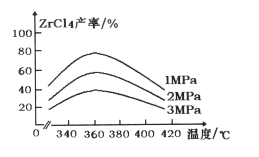
(1) “氯化”过程中,锆英石发生的主要反应的化学方程式为:______________________________,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_____________;
(2)“滤液1”中含有的阴离子除OH- 、Cl-,还有___________________;
(3)常用的铜抑制剂有Na2S、H2S、NaCN等,本流程使用NaCN除铜,不采用Na2S、H2S的原因是__________。
(4)实验室进行萃取和反萃取的玻璃仪器是_______。流程中萃取与反萃取的目的是_________。
【答案】)ZrSiO4+4CO+4Cl2 ![]() ZrCl4 +SiCl4+4CO2 360℃、1MPa AlO2- 、SiO32- S2-会将Fe3+还原成Fe2+,影响下一步除铁,同时可能会产生污染性气体 分液漏斗、烧杯 除去铁元素杂质
ZrCl4 +SiCl4+4CO2 360℃、1MPa AlO2- 、SiO32- S2-会将Fe3+还原成Fe2+,影响下一步除铁,同时可能会产生污染性气体 分液漏斗、烧杯 除去铁元素杂质
【解析】
根据流程:天然锆石的主要成分是ZrSiO4(还常含有Fe、Al、Cu的氧化物杂质),将粉碎后的天然锆石用CO、Cl2氯化得到ZrCl4、SiCl4、AlCl3、FeCl3、CuCl2;用NaOH溶液碱浸时,SiCl4、AlCl3溶解为硅酸钠、偏铝酸钠,ZrCl4、FeCl3、CuCl2反应为Zr(OH)4、Fe(OH)3、Cu(OH)2沉淀,即为滤渣1;用盐酸溶解滤渣1得到ZrCl4、FeCl3、CuCl2;加入铜抑制剂除去铜[铜抑制剂可以为NaCN,生成沉淀为Cu(CN)2],滤渣2为Cu(CN)2;向滤液2加入NH4SCN与ZrCl4、FeCl3发生配合反应得到Fe(SCN)3、Zr(SCN)4,加入 有机溶剂MIBK萃取,Fe(SCN)3难溶于MIBK,分液,Zr(SCN)4在有机层,将含有Zr(SCN)4的有机层用硫酸反萃取将Zr(SCN)4与MIBK分离;通入氨气沉锆,经过煅烧得到ZrO2,据此分析作答。
(1) 氯化过程中ZrSiO4与CO、Cl2在高温下反应生成ZnCl4、SiCl4和CO2,反应的化学方程式为:ZrSiO4+4CO+4Cl2![]() ZnCl4+SiCl4+4CO2;由图可知,360℃、1MPa时,ZrCl4产率最高,此为氯化最佳条件;
ZnCl4+SiCl4+4CO2;由图可知,360℃、1MPa时,ZrCl4产率最高,此为氯化最佳条件;
(2)由流程分析可知,“滤液1”中含有的阴离子除OH- 、Cl-,还有AlO2- 、SiO32-;
(3)三价铁具有氧化性,S2-会将Fe3+还原成Fe2+,发生的反应为2Fe3++H2S=2Fe2++S+2H+(2Fe3++S2-=2Fe2++S),影响下一步除铁,同时可能会产生污染性H2S气体,故本流程使用NaCN除铜,不采用Na2S、H2S;
(4)实验室进行萃取和反萃取的玻璃仪器是分液漏斗、烧杯;根据已知信息“生成的Fe(SCN)3难溶于MIBK,Zr(SCN)4在水中的溶解度小于在MIBK中的溶解度”可知,流程中萃取与反萃取的目的是除去铁元素杂质。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向![]() 溶液中加入少量氨水:
溶液中加入少量氨水:![]() ==Al(OH)3
==Al(OH)3![]()
B. 向![]() 溶液中加入KOH溶液:HCO3-+OH-═H2O+CO2↑
溶液中加入KOH溶液:HCO3-+OH-═H2O+CO2↑
C. 向![]() 溶液中加入过量的NaOH溶液:
溶液中加入过量的NaOH溶液:![]()
D. 向![]() 溶液中加入过量澄清石灰水:
溶液中加入过量澄清石灰水:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为几种化合物的元素组成示意图,以下说法错误的是

A. 若①为某种具有催化作用的化合物,则其水解产物为氨基酸
B. 若②为脂肪,则其大量积累于皮下和内脏器官周围
C. 若③为蓝藻的遗传物质,则其和蛋白质组成染色体
D. 若④为糖原,则其主要分布在人和动物的肌肉和肝脏中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A. 11.2gB. 5.6gC. 2.8gD. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 为地壳中含量最高的过渡金属元素,
为地壳中含量最高的过渡金属元素,![]() 与
与![]() 同主族,
同主族,![]() 与
与![]() 同周期,且
同周期,且![]() 与
与![]() 的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
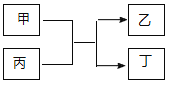
A.![]() 、
、![]() 形成的一种化合物具有漂白性
形成的一种化合物具有漂白性
B.![]() 、
、![]() 形成的离子化合物可能含有非极性键
形成的离子化合物可能含有非极性键
C.![]() 的单质能与丙反应置换出
的单质能与丙反应置换出![]() 的单质
的单质
D.丁为黑色固体,且1mol甲与足量丙反应转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)如下图装置实验,A、B两烧杯分别盛放200 g10%NaOH和足量CuSO4溶液。通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5 g(不考虑水的蒸发)。
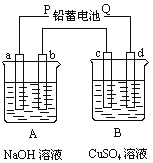
请回答下列问题:
(1)电源P极为 极;请分别写出b极和c极上发生的电极反应 式: ;
(2)c极上析出固体铜的质量为 g
(3)若装置中用铅蓄电池作电源,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42 -=PbSO4+2e-
正极:PbO2+4H++SO42 -+2e-=PbSO4+2H2O
假设在a极制得气体0.050 mol,这时电池内消耗的H2SO4的物质的量至少是 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是____________。
②氨催化氧化生成一氧化氮反应的化学方程式是___________。
(2)氨的定量检测。水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
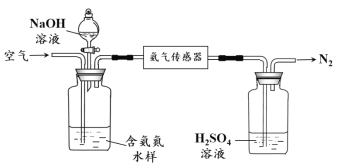
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:_______________。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol,则水样中氨氮(以氨气计)含量为________mg·L-1。
(3)氨的转化与去除。 微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
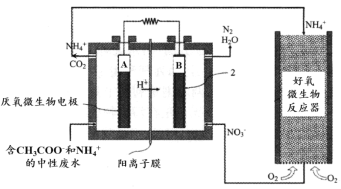
已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com