
【题目】在等体积的NaCl、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为( )
A.1:2:3
B.3:2:1
C.1:1:1
D.6:3:2
科目:高中化学 来源: 题型:
【题目】在一定温度下,向某恒容的密闭容器中加入1 mol N2和3 mol H2,发生反应:N2(g)+ 3H2(g)![]() 2NH3(g)。此反应达到平衡的标志是( )
2NH3(g)。此反应达到平衡的标志是( )
A. N2、H2和NH3三者共存 B. 容器内气体的浓度不再发生变化
C. N2、H2和NH3的物质的量浓度相等 D. 单位时间消耗0.1molN2的同时生成0.2 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法正确的是
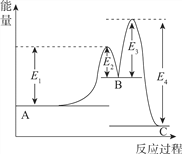
A. 两步反应的ΔH均大于0 B. 加入催化剂能改变反应的焓变
C. 三种物质中C最稳定 D. A→C反应的ΔH=E4-E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 钠和水反应:Na+H2O==Na++OH-+H2↑
B. 盐酸与氢氧化钠溶液反应:H++OH-==H2O
C. 三氯化铁腐蚀印刷线路板:Fe3++Cu==Fe2++Cu2+
D. 醋酸与碳酸钠反应制备二氧化碳:CO32-+2H+==CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 良好的生态环境可以提升生活质量。
① 下列物质不属于空气质量周报中污染物的是________(填字母)。
a. SO2 b. NO2 c. PM2.5
② 垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有________(填字母)标志的垃圾桶内。

③ 燃烧煤产生的SO2所形成的酸雨中,SO2最终转化成的酸是________(填化学式)。
(2) 右图是某品牌调料标签的一部分。

① 配料中的大量氨基酸态氮来源于黄豆中的蛋白质发生________反应得到。
② 小麦粉中的主要营养物质是________。
③ 配料表中属于防腐剂的是________。
④ 配料表中的辣椒红是着色剂。亚硝酸钠也可作着色剂,但亚硝酸钠有毒,要严格控制其用量。亚硝酸钠外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
性质 | 亚硝酸钠 | 氯化钠 |
1. 酸性条件下的稳定性 | 微热分解为NO和NO2 | 微热时不分解 |
2. 熔点 | 271 ℃ | 801 ℃ |
3. 室温时的溶解度 | 约80 g | 约35 g |
请根据表中信息设计一种鉴别NaNO2和NaCl的方法,写出简单的操作过程、现象和结论:________。
(3) 材料是人类赖以生存和发展的重要物质基础。
① 钢铁是应用广泛的金属材料。钢铁在潮湿空气中易生锈,铁锈的主要成分是____________(填化学式),请列举一种防止钢铁腐蚀的方法:________。
② 水泥、玻璃、陶瓷是生活中常见的硅酸盐材料。制备普通玻璃的原料有CaCO3、________和________(填化学式)。青瓷是中国最早发明的瓷器,青瓷表面的绿色是釉层中的________价铁元素显色而成的。
③ 氮化硅陶瓷抗腐蚀能力强,工业上可用四氯化硅和氮气在氢气气氛中加强热发生反应制得。请写出该反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯可用作茉莉、白兰、月下香等香精的调合香料。它可以用甲苯和乙烯为原料进行人工合成。合成路线如下:
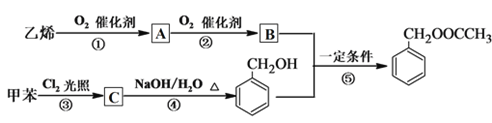
已知:R—Cl![]() R—OH
R—OH
(1)写出以下反应类型:反应②______________、反应⑤____________。
(2)写出以下反应的化学方程式:
反应①_________________________,反应③________________________。
(3)甲苯的一氯代物有________种。
(4)反应③可能生成的副产物为___________(写一种)。
(5)请设计合理方案从![]() 合成
合成 。已知:①CH3CH=CH2
。已知:①CH3CH=CH2![]() CH3CH2CH2Br;②CH3CH2Br
CH3CH2CH2Br;②CH3CH2Br![]() CH3CH2OH
CH3CH2OH
提示:①合成过程中无机试剂任选;
②合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br
_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其生产工艺如下:
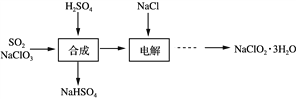
(1) “合成”步骤可以得到ClO2,其反应的化学方程式为_____________________________。
(2) “电解”步骤阳极会生成一种气体,其化学式为____________ 。
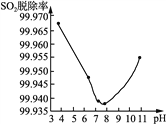
(3) 反应生成的ClO2可用于高效脱除烟气中的SO2。以ClO2脱除SO2实验时SO2脱除率与溶液pH关系如右图所示。pH在3~7.6之间时,随pH增大,ClO2氧化性减弱,脱硫率降低。而当pH>7.6时,随pH增大,SO2脱除率又升高,其原因可能为_____________________________________。
(4) 国家标准规定产品中优级纯试剂纯度≥99.8%,分析纯试剂纯度≥99.7%,化学纯试剂纯度≥99.5%。为了确定某批次NaClO2产品的等级,研究小组设计测定方案如下:取10.00 g样品,用适量蒸馏水溶解后,加入略过量的KI溶液;充分反应后,将反应液定容至200 mL,取出20.00 mL于锥形瓶;向锥形瓶中滴加两滴淀粉溶液,用2.00 mol·L-1的Na2S2O3溶液与之反应,消耗Na2S2O3溶液22.00 ml。该样品可达________试剂纯度。(写出计算过程)
已知:ClO![]() +4I-+4H+===2H2O+2I2+Cl-,I2+2S2O
+4I-+4H+===2H2O+2I2+Cl-,I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼在地壳中的含量不多,主要存在于硼镁矿、硼砂等富集矿中。回答下列问题:
(1)基态硼原子的核外电子排布式为_______;硼元素的某种同素异形体B12的熔点位2180℃,据此推测B12晶体熔化时破坏的作用力为__________。
(2)硼与其同周期相邻两元素的第一电离能由大到小的顺序是__________。
(3)硼原子最外层只有三个电子,但其电负性较大,原因是_________。
(4)正硼酸(H3BO3)是白色固体,其晶体具有六方形对称片状晶格结构,如图所示。
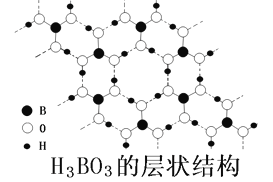
①正硼酸分子中的B原子采取__________杂化;1molH3BO3平均形成________mol氢键。
②正硼酸的熔点远远高于硼酸甲酯[B(OCH3)3],原因是________。
(5)写出与BF3互为等电子体的2种阴离子_________(填化学式)。
(6)下图为立方氟化硼晶胞结构示意图,其中N原子的配位数为____;若N原子半径为a pm,B原子半径为b pm,阿伏伽德罗常数值为NA,则立方氮化硼晶体的密度为________g/cm3(列式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按化合物、单质、混合物顺序排列的是( )
A.空气、氮气、胆矾
B.稀盐酸、液态氧、碘酒
C.干冰、铁、氯化氢
D.氧化钙、白磷、石灰水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com