
价电子总数与原子总数都相同的分子、离子或原子团称为等电子体,等电子体具有相似的结构和性质。下列选项中互称为等电子体的是
A.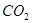 和
和  B.
B.
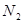 和
和 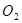
C.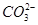 和
和 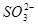 D.
D.
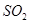 和
和 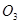
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2和 NO2 | ||||
| B、N2和 O2 | ||||
C、C
| ||||
| D、SO2和 O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
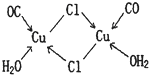
几何学是解决物质结构问题的基础。C60(每个碳原子与周围3个碳原子相连,如下图)是一系列碳原子簇合物(即富勒烯)的一个典型代表,它的应用十分广泛,涉及光学、信息学、药物学、催化、储氢、超导等。就其结构而言也很特殊。18世纪俄罗斯数学家莱昂哈德·欧拉通过理论论证,明确指出任何一个这样的多面体都必须恰好具有12个五边形方能闭合成多面体。试回答:

(1)由12个五边形构成的最小碳笼的化学式为__________________________________,计算过程为_________________________。
(2)除碳原子能形成笼形球状分子外,实验中还发现了以金属原子部分取代碳原子的“金属——碳原子”团簇分子,即金属碳烯,若金属碳烯的价电子总数与碳原子团簇分子的价电子总数相等,你认为能代替碳原子的金属有____________________________________(填在周期表中的位置)。
(3)在最小的金属碳烯原子簇化合物中,金属与碳原子个数比为2∶3,这种最小金属碳烯团簇分子的化学式为_____________________________(用M代金属)。
(4)计算机技术的发展带动了理论化学的发展。最近,美国研究人员通过理论计算证明,可以用24个X原子和24个Y原子代替48个碳原子形成C12X24Y24新的团簇分子。若已知这种全非金属团簇分子与C60价电子总数相等,且X、Y、C元素位于同一周期,X的原子半径小于Y的原子半径,则在12个五边形中,每个五边形中有___________个X原子,有___________个Y原子,X是___________元素,Y是___________元素。
(5)目前,化学家已经找到十余种富勒烯家族成员,如C28、C32、C50、C60、C70……(富勒烯家族成员还在增加),它们的分子结构都是由正五边形和正六边形构成的封闭的凸多面体,则C80结构中五边形和六边形的个数分别是_________和_________。
(6)下列物质不属于富勒烯家族的有___________。
A.C18 B.C44 C.C72 D.C83
(7)晶体硼的基本结构单元是由硼原子组成的正二十面体(如下图所示)。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有一个硼原子。请根据观察和计算确定:

①该基本结构单元内,所含硼原子的个数为__________;所含B—B键的数目是__________。
②若将晶体硼结构单元的每个顶角削去,余下部分就和C60晶体的结构相同。据此确定,C60是由__________个正六边形和__________个正五边形构成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com