
【题目】某同学设计如下图所示装置,探究氯碱工业原理,下列说法正确的是
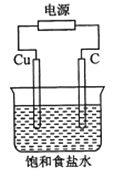
A.石墨电极与直流电源负极相连
B.用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色
C.氢氧化钠在石墨电极附近产生, Na+向石墨电极迁移
D.铜电极的反应式为:2H++ 2e-= H2↑
科目:高中化学 来源: 题型:
【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常用下列方法处理,以实现节能减排、废物利用等。已知:25℃ 时,Kb(NH3·H2O)=1.8×10-5; H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7。
(1)处理烟气中的SO2常用液吸法。室温条件下,将烟气通入浓氨水中得到(NH4)2SO3溶液,0.1mol/L(NH4)2SO3溶液的pH____(填“>”“<”或“=”)7。
(2)用活性炭可以还原处理氮氧化物,有关反应为C(s)+2NO(g) N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到平衡状态的依据是 ________(填选项编号)。
A.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
B.混合气体的密度不再发生改变
C.反应体系的压强不再发生改变
D.混合气体的平均相对分子质量不再改变
(3)有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸气和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80% 时放出热量19.6kJ能量,写出该反应的热化学方程式__________________。
②一定条件下,往 2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下,相同时间内 CO2的转化率随温度的变化如图1所示:
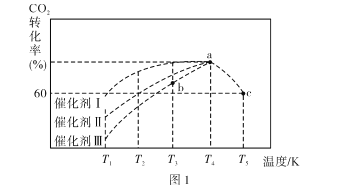
催化剂效果最佳的是催化剂________(填“Ⅰ”“Ⅱ”“Ⅲ”)。b点v( 正 )________v( 逆 )( 填“>”“<”或“=”) 。此反应在 a 点时已达平衡状态,a 点的转化率比 c 点高的原因_____。已知容器内的起始压强为100kPa,则图中c点对应温度下反应的平衡常数Kp=____________KPa-2 。(保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)
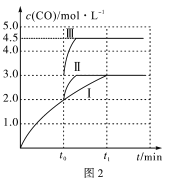
(4)一定条件下,CO2和H2也可以发生反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH<0,一定温度下,在3L容积可变的密闭容器中发生如上反应,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,有漂白性,能与水、酸性氧化物和酸反应。
(1)一定条件下,m克的H2、CO的混合气体在足量的氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重___克。
(2)常温下,将14.0克的Na2O和Na2O2的混合物放入水中,得到400mLpH=14的溶液,则产生的气体标准状况下体积为___L。
(3)在200mLAl2(SO4)3和MgSO4的混合液中,加入一定量的Na2O2充分反应,至沉淀质量不再减少时,测得沉淀质量为5.8克。此时生成标准状况下气体体积为5.6L。则原混合液中c(SO42-)=___mol/L。
(4)取17.88gNaHCO3和Na2O2的固体混合物,在密闭容器中加热到250℃,经充分反应后排出气体,冷却后称得固体质量为15.92g。请列式计算:
①求原混合物中Na2O2的质量B___;
②若要将反应后的固体反应完,需要1mol/L盐酸的体积为多少毫升___?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
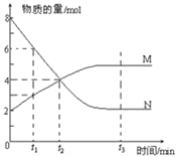
(1)该反应的化学方程式是_____________________________
(2)在图上所示的三个时刻中___________(填t1、t2或t3)时刻处于平衡状态,此时v正________v逆(填>、<或=);达到平衡状态后,平均反应速率v(N):v(M)=___________
(3)若反应容器的容积不变,则“压强不再改变”_________(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是________(选填字母) A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
(5)向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O22SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为________;平衡时SO3的物质的量浓度________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物广泛应用于太阳能的利用、光导纤维及硅橡胶的制备等.
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取.高温下制取纯硅有如下反应(方法Ⅰ):
①SiO2(s)+2C(s)Si(s)+2CO(g)
②Si(s)+2Cl2(g)SiCl4(g)
③SiCl4(g)+2H2(g)→Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有______ 种不同能级的电子,最外层p电子有______种自旋方向;SiO2晶体中每个硅原子与______个氧原子直接相连.
(2)单质的还原性:碳______硅(填写“同于”、“强于”或“弱于”).从平衡的视角而言,反应①能进行的原因是______.
(3)反应②生成的化合物分子空间构型为;该分子为______分子(填写“极性”或“非极性”).
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L.然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L.则:a______b(填写“大于”、“等于”或“小于”).
(5)在t秒内,反应②中反应速率v(SiCl4)=______(用含a、b的代数式表示).
(6)工业上还可以通过如下反应制取纯硅(方法Ⅱ):
④Si(粗)+3HCl(g)![]() SiHCl3(l)+H2(g)+Q(Q>0)
SiHCl3(l)+H2(g)+Q(Q>0)
⑤SiHCl3(g)+H2(g)![]() Si(纯)+3HCl(g)
Si(纯)+3HCl(g)
提高反应⑤中Si(纯)的产率,可采取的措施有:______、______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
A. c(H+)/c(NH4+) B. c(NH3·H2O)/ c(OH-)
C. c(NH4+) c(OH-)/c(NH3·H2O) D. c(H+)c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,CH3COOH的电离常数Ka=1.8×10-5。常温下,往25mL氢氧化钠标准溶液中逐滴加入0.1mol·L-1的CH3COOH溶液,pH变化曲线如图所示:
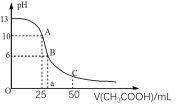
(1)该氢氧化钠溶液的物质的量浓度为__。
(2)A点对应的横坐标为25mL,请用离子方程式解释A点所示的溶液显碱性的原因:__。
(3)A点所示的溶液中各离子浓度由大到小的排列顺序是:______。
(4)B点所示溶液中,![]() =___。
=___。
(5)C点所示溶液为等浓度的CH3COONa和CH3COOH混合溶液,请判断该溶液中c(CH3COOH)__c(CH3COO-)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干电池是日常生活中常用的电池,原料为Zn和MnO2。某工厂用软锰矿(含MnO2约70%及杂质Al2O3)和闪锌矿(含ZnS约80%及少量FeS杂质)共同生产。流程如下:

已知:①A是ZnSO4、MnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②Ⅳ中反应的方程式为:MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。
(1)混合物A中,属于还原产物的是______(填化学式)。
(2)加入X的作用是_____________________。已知溶液中各离子开始沉淀的pH如表所示,则加入X后,溶液pH应调整到_____(填字母)。
A.4.5 B.8.0 C.6.5 D.9.0
离子 | 开始沉淀pH | 完全沉淀pH |
Fe3+ | 2.3 | 3.2 |
Al3+ | 4.2 | 5.4 |
Zn2+ | 7.2 | 8.0 |
Mn2+ | 8.3 | 9.8 |
步骤Ⅱ加热的原因是____________________。适宜作为X加入步骤Ⅱ的物质为______(填字母)。
A.MnCO3 B.Zn2(OH)2CO3 C.NaOH D.KOH
(3)生产过程中除矿石外,还有哪些原料需要购买?____________(填化学式)。
(4)若要从步骤Ⅳ的过滤中得到芒硝晶体(Na2SO4·10H2O),则需要进行的实验操作有________、________、过滤、洗涤、干燥等。
查看答案和解析>>
科目:高中化学 来源: 题型:
![]()
![]() 【题目】实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末可能是( )
【题目】实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末可能是( )
![]()
![]() A.
A.![]() B.
B.![]() 和
和![]()
C.![]() 和
和![]() D.
D. ![]() 和FeO
和FeO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com