
【题目】硅及其化合物广泛应用于太阳能的利用、光导纤维及硅橡胶的制备等.
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取.高温下制取纯硅有如下反应(方法Ⅰ):
①SiO2(s)+2C(s)Si(s)+2CO(g)
②Si(s)+2Cl2(g)SiCl4(g)
③SiCl4(g)+2H2(g)→Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有______ 种不同能级的电子,最外层p电子有______种自旋方向;SiO2晶体中每个硅原子与______个氧原子直接相连.
(2)单质的还原性:碳______硅(填写“同于”、“强于”或“弱于”).从平衡的视角而言,反应①能进行的原因是______.
(3)反应②生成的化合物分子空间构型为;该分子为______分子(填写“极性”或“非极性”).
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L.然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L.则:a______b(填写“大于”、“等于”或“小于”).
(5)在t秒内,反应②中反应速率v(SiCl4)=______(用含a、b的代数式表示).
(6)工业上还可以通过如下反应制取纯硅(方法Ⅱ):
④Si(粗)+3HCl(g)![]() SiHCl3(l)+H2(g)+Q(Q>0)
SiHCl3(l)+H2(g)+Q(Q>0)
⑤SiHCl3(g)+H2(g)![]() Si(纯)+3HCl(g)
Si(纯)+3HCl(g)
提高反应⑤中Si(纯)的产率,可采取的措施有:______、______.
【答案】5 1 4 弱于 因为生成物CO为气态,降低CO的浓度,可使平衡正向移动 非极性 小于 ![]() mol/(Ls) 降低压强 升高温度(或及时分离出HCl等) .
mol/(Ls) 降低压强 升高温度(或及时分离出HCl等) .
【解析】
(1)硅原子电子排布式:1s22s22p63s23p2,核外有5种不同能级的电子,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先占据不同轨道,而且自旋方向相同,最外层的p电子有1种自旋方向;SiO2晶体中每个硅原子与4个氧原子形成4个SiO共价键;故答案为:5;1;4;
(2)非金属性越强单质的氧化性越强,碳的还原性弱于硅;减少生成物CO的浓度,平衡正向移动;故答案为:弱于;因为生成物CO为气态,降低CO的浓度,可使平衡正向移动;
(3)四氯化硅是正四面体结构,SiCl4分子结构对称结构,属于非极性分子;故答案为:正四面体型;非极性;
(4)体积减小,压强增大,平衡正向移动,氯气的物质的量减小,但体积减小更大,浓度增大;故答案为:小于;
(5)氯气的反应速率![]() ,
,![]() ;
;
(6)该反应正向为气体体积增大的反应,降低压强可使平衡正向移动;该反应为吸热反应,升高温度可使反应正向移动;及时分离出HCl,使生成物浓度降低,可使平衡正向移动,故答案为:降低压强;升高温度(或及时分离出HCl等)。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
该小组用下图所示装置进行实验(夹持仪器略)
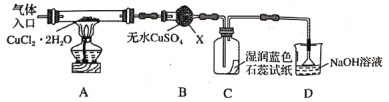
已知实验操作的步骤为:a.检查装置的气密性后加入药品→b.在“气体入口”处通入干燥HCl→c.点燃酒精灯,加热→d.反应一段时间,熄灭酒精灯,冷却→e.停止通入HCl,然后通入N2
(资料查阅)![]()
请回答下列问题:
(1)仪器X的名称是___________。
(2)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是___________。
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质。根据资料信息
①若杂质是CuCl2,则产生的原因是_______________。
②若杂质是CuO,则产生的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:氧化还原反应中实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:NO3-+4H++3e-=NO+2H2O ,已知Cu2O(甲)能使上述还原过程发生.
(1)写出并配平该氧化还原反应的方程式:__________________________________.
(2)反应中硝酸体现了____________、__________性质.
(3)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是__________.
II:现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;②2BrO3- +I2 = 2IO3- + Br2;请回答下列问题:
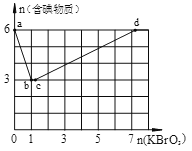
(4)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式______。
(5)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为___________mol。
(6)n(KBrO3)=4时,对应含碘物质的化学式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下图所示装置,探究氯碱工业原理,下列说法正确的是
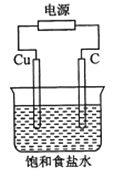
A.石墨电极与直流电源负极相连
B.用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色
C.氢氧化钠在石墨电极附近产生, Na+向石墨电极迁移
D.铜电极的反应式为:2H++ 2e-= H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
A. 处于平衡状态,正逆反应速率相等B. 改变条件后,化学平衡常数一定改变
C. 反应逆向进行,正反应速率小于逆反应速率D. 升高温度,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:

经操作I得到粗胆矾,操作III得到精制胆矾。两步操作相同,具体包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
已知:![]() 、
、![]() 、
、![]() 转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
|
|
| |
开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
(1)溶解、过滤需要用到玻璃棒,它的作用是________。
(2)写出加入3% H2O2后发生反应的离子方程式_______。(原溶液显酸性)。
(3)加稀氨水调节pH应调至范围______。下列物质可用来替代稀氨水的是___。(填字母)
A.NaOH B.Cu(OH)2C.CuO D.NaHCO3
(4)操作III析出胆矾晶体后,溶液中还可能存在的溶质为CuSO4、H2SO4、________________。
(5)某学生用操作III所得胆矾进行“硫酸铜晶体结晶水含量”的测定,数据记录如下表所示:
第一次实验 | 第二次实验 | |
坩埚质量(g) | 14.520 | 14.670 |
坩埚质量 | 17.020 | 18.350 |
第一次加热、冷却称量(g) | 16.070 | 16.989 |
第二次加热、冷却、称量(g) | 16.070 | 16.988 |
两次都无须再做第三次加热、冷却、称量,理由是______,该生此次实验的相对误差为__%(保留1位小数),产生实验误差的原因可能是___(填字母)。
A.加热前称量时坩埚未完全干燥 B.该胆矾中含有受热不分解的杂质
C.加热后坩埚放在干燥器中冷却 D.玻璃棒上沾有的固体未刮入坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,某同学做了如下实验:
①将2.3 g该有机物完全燃烧,生成0.1mol CO2和2.7g水;
②用质谱仪测定其相对分子质量,得图所示的质谱图;

③用核磁共振仪处理该化合物,得图所示图谱,图中三个峰的面积之比是1∶2∶3。

试回答下列问题:
(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com