
【题目】I:氧化还原反应中实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:NO3-+4H++3e-=NO+2H2O ,已知Cu2O(甲)能使上述还原过程发生.
(1)写出并配平该氧化还原反应的方程式:__________________________________.
(2)反应中硝酸体现了____________、__________性质.
(3)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是__________.
II:现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;②2BrO3- +I2 = 2IO3- + Br2;请回答下列问题:
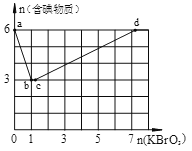
(4)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式______。
(5)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为___________mol。
(6)n(KBrO3)=4时,对应含碘物质的化学式为___________________。
【答案】14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O 酸性 氧化性 使用了较浓的硝酸,产物中有部分二氧化氮生成 BrO3-+5Br-+6H+=3Br2+3H2O 7.2 I2,KIO3
【解析】
本题主要是考察氧化还原的综合应用,包括方程的配平,图像分析及关系式计算,在配平方程式时要紧抓得失电子守恒。
I(1)根据已知的还原过程和氧化过程的反应物可与推导出,Cu2O会被氧化成![]() ,根据氧化还原反应的配平原则,得失电子守恒,可写出,该反应式为:14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O;(2)由方程式可知,反应中硝酸生成了Cu(NO3)2和NO,所以体现了硝酸的酸性和氧化性;(3)1mol甲与某浓度硝酸反应时,若还原产物是
,根据氧化还原反应的配平原则,得失电子守恒,可写出,该反应式为:14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O;(2)由方程式可知,反应中硝酸生成了Cu(NO3)2和NO,所以体现了硝酸的酸性和氧化性;(3)1mol甲与某浓度硝酸反应时,若还原产物是![]() ,则
,则![]() ,若还原产物是
,若还原产物是![]() ,则有
,则有![]() ,在Cu2O一定的情况下,后者消耗的硝酸量更多,所以被还原硝酸的物质的量增加,则产物有
,在Cu2O一定的情况下,后者消耗的硝酸量更多,所以被还原硝酸的物质的量增加,则产物有![]() 生成;
生成;
故答案为:14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O;酸性;氧化性;使用了较浓的硝酸,产物中有部分二氧化氮生成;
II(4)结合图和已知条件可知,![]() 阶段是反应①,
阶段是反应①,![]() 段是反应②,在
段是反应②,在![]() 段,含碘物质的物质的量没有发生变化,而题上说明只有一种元素的化合价发生变化,所以在
段,含碘物质的物质的量没有发生变化,而题上说明只有一种元素的化合价发生变化,所以在![]() 段是Br的化合价发生变化,此处发生价态归中反应:BrO3-+5Br-+6H+=3Br2+3H2O;(5)根据三段过程可以列出对应的关系式:在
段是Br的化合价发生变化,此处发生价态归中反应:BrO3-+5Br-+6H+=3Br2+3H2O;(5)根据三段过程可以列出对应的关系式:在![]() 阶段有
阶段有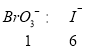 ,
,![]() 段
段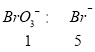 ,
,![]() 段有
段有![]() ,含6 mol KI的硫酸溶液,消耗n(KBrO3)=
,含6 mol KI的硫酸溶液,消耗n(KBrO3)=![]() ;(6)当n(KBrO3)=4时,图像处于
;(6)当n(KBrO3)=4时,图像处于![]() 段,对应反应②2BrO3- +I2 = 2IO3- + Br2,则对应含碘物质的化学式有:I2,KIO3;
段,对应反应②2BrO3- +I2 = 2IO3- + Br2,则对应含碘物质的化学式有:I2,KIO3;
span>故答案为:BrO3-+5Br-+6H+=3Br2+3H2O ;7.2;I2、KIO3。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】咖啡中含有的咖啡酸能使人心脑血管更年轻。咖啡酸(分子式:C9H8O4)的球棍模型如图所示,下列有关咖啡酸的叙述不正确的是
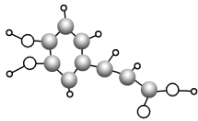
A.图中最小的小球表示氢原子
B.咖啡酸中含有碳碳双键
C.咖啡酸可以发生消去反应、酯化反应
D.1mol咖啡酸最多可与3mol Br2发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
实 验 步 骤 | 现 象 | 结 论 |
①分别取等体积的2 mol/L硫酸于试管中; | 反应快慢: | 反应物的性质越活泼, |
(1)该同学的实验目的是_________________________________________;
要得出正确的实验结论,还需控制的实验条件是_____________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品可以是(从题中所给药品中挑选)_________________________________________________________;
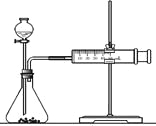
实验二:
已知: 2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是__________________。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氯苯制取1,2,3,4一四氯己烷,步骤如下
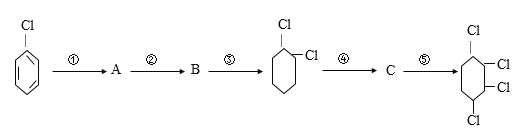
(1)填写每步所属的反应类型(a.取代反应b.加成反应 c.消去反应,只需填写字母):①_________、②____________、③___________、④________、⑤__________
(2)反应②所需要的试剂和条件是_________________________;
(3)反应④⑤的化学方程式是④______________⑤________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 滴入酚酞显红色的溶液:Na+、NH4+、NO3-、Cl-
B. 0.1mol·L-1Fe(NO3)2溶液:H+、Al3+、SO42-、Cl-
C. 0.1mol·L-1氨水溶液:K+、Na+、NO3-、A1O2-
D. c(H+)/c(OH-)=1012mol·L-1的溶液:Ca2+、NH4+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,有漂白性,能与水、酸性氧化物和酸反应。
(1)一定条件下,m克的H2、CO的混合气体在足量的氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重___克。
(2)常温下,将14.0克的Na2O和Na2O2的混合物放入水中,得到400mLpH=14的溶液,则产生的气体标准状况下体积为___L。
(3)在200mLAl2(SO4)3和MgSO4的混合液中,加入一定量的Na2O2充分反应,至沉淀质量不再减少时,测得沉淀质量为5.8克。此时生成标准状况下气体体积为5.6L。则原混合液中c(SO42-)=___mol/L。
(4)取17.88gNaHCO3和Na2O2的固体混合物,在密闭容器中加热到250℃,经充分反应后排出气体,冷却后称得固体质量为15.92g。请列式计算:
①求原混合物中Na2O2的质量B___;
②若要将反应后的固体反应完,需要1mol/L盐酸的体积为多少毫升___?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性炭吸附法是工业提碘的主要方法之一,其流程如图:
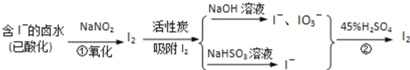
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将I﹣氧化为I2,同时生成NO.写出反应①的离子方程式______.
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中的I﹣选择了价格并不便宜的亚硝酸钠,可能的原因是______.
(3)反应②发生时,溶液底部有紫黑色固体生成,有时溶液上方产生紫色气体,产生这种现象的原因是______.
(4)流程中,碘元素经过了I﹣→I2→I﹣、IO3﹣→I2的变化过程,这样反复操作的目的是______.
(5)流程中所用的NaHSO3溶液显弱酸性,源于NaHSO3存在以下两种程度不同的平衡体系:
①水解______和电离______(用离子方程式表示)
②如向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
加入少量Ba(OH)2固体,水解平衡向______移动;加入少量NaClO固体,溶液的pH______(选填:增大、减小、不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物广泛应用于太阳能的利用、光导纤维及硅橡胶的制备等.
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取.高温下制取纯硅有如下反应(方法Ⅰ):
①SiO2(s)+2C(s)Si(s)+2CO(g)
②Si(s)+2Cl2(g)SiCl4(g)
③SiCl4(g)+2H2(g)→Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有______ 种不同能级的电子,最外层p电子有______种自旋方向;SiO2晶体中每个硅原子与______个氧原子直接相连.
(2)单质的还原性:碳______硅(填写“同于”、“强于”或“弱于”).从平衡的视角而言,反应①能进行的原因是______.
(3)反应②生成的化合物分子空间构型为;该分子为______分子(填写“极性”或“非极性”).
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L.然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L.则:a______b(填写“大于”、“等于”或“小于”).
(5)在t秒内,反应②中反应速率v(SiCl4)=______(用含a、b的代数式表示).
(6)工业上还可以通过如下反应制取纯硅(方法Ⅱ):
④Si(粗)+3HCl(g)![]() SiHCl3(l)+H2(g)+Q(Q>0)
SiHCl3(l)+H2(g)+Q(Q>0)
⑤SiHCl3(g)+H2(g)![]() Si(纯)+3HCl(g)
Si(纯)+3HCl(g)
提高反应⑤中Si(纯)的产率,可采取的措施有:______、______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃硝酸钾饱和溶液先升温至80℃,在恒温下蒸发部分溶剂至析出少量溶质,然后将溶液逐渐冷却至60℃.下列示意图中能正确表示整个过程中溶液浓度a%与时间t关系的是( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com