
短周期主族元素X、Y、Z、W、Q的原子序数依次增大。X的气态氢化物极易溶于Y的氢化物中,常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A.元素Y的最高正化合价为+6
B.离子半径的大小顺序为W>Q>Z>X>Y
C.气态氢化物的沸点:Y>W
D.元素W的最高价氧化物对应的水化物酸性比Q的强
C
【解析】
试题分析:根据题意可知:X是N;Y是O;Z是Al;W是S;Q是Cl。A.由于O元素的原子半径小,获得电子的能力强,所以元素Y的最高正化合价不等于原子的最外层电子数,错误;B.对于电子层结构不同的元素来说,元素离子的核外电子层数越多,离子半径就越大;对于电子层结构相同的元素来说,核电荷数越大,离子半径就越小。所以离子半径的大小顺序为W>Q >X>Y >Z,错误;C.元素的非金属性越强,去气态氢化物的稳定性就越强,由于元素的非金属性Y>W,所以气态氢化物的沸点:Y>W,正确;D.元素的非金属性越强,其对应的最高价氧化物对应的水化物的酸性就越强。元素的非金属性Q>W,所以元素Q的最高价氧化物对应的水化物酸性比W的强,错误。
考点:考查元素周期表、元素周期律的知识。


科目:高中化学 来源:2015届江西省高三上学期第一次考试化学试卷(解析版) 题型:计算题
(9分)(1)在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为
1.18 g·cm-3。试计算:
①所得盐酸物质的量浓度是 。
②取出这种盐酸10 mL,稀释至118 mL,所得稀盐酸的物质的量浓度是 。如取10 mL盐酸时仰视其他操作均正确得稀盐酸浓度 。(填“偏大”、 “等于”、“偏小”)
③在40.0 mL 0.065 mol·L-1 Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过 mL。
(2)配制0.80 mol·L-1 NaOH溶液475 mL,回答下列问题:
①根据计算用托盘天平称取NaOH的质量为__________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度_______0.80 mol·L-1(填“大于”、“等于”或“小于”,下同)。若还未等溶液冷却就定容了,则所得溶液浓度__________0.80 mol·L-1。
②0.80 mol·L-1 NaOH溶液质量分数 3.2%,和等质量的水混合溶液浓度 0.40 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015届江西五校高三第一次联考化学试卷(解析版) 题型:填空题
(9分)A、B、C、D、E为原子序数依次增大的短周期元素。已知A、B、E三原子最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水;C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。请回答下列问题:
(1)写出下列元素符号:A________,C________,E________。
(2) E元素+1价含氧酸的电子式为:_________________。
(3)写出A、B两元素最高价氧化物对应的水化物相互反应的离子方程式______________。
(4)比较C、D最高价氧化物对应水化物的酸性__________________。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省苏州市高三9月学情调研化学试卷(解析版) 题型:填空题
(12分)已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如下图:
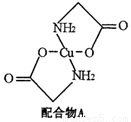
(1)Cu元素基态原子的外围电子排布式为。
(2)元素C、N、O的第一电离能由大到小排列顺序为。
(3)配合物A中碳原子的轨道杂化类型为。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有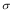 键的数目为。
键的数目为。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,
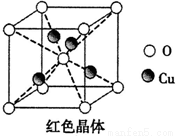
则该化合物的化学式是。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省苏州市高三9月学情调研化学试卷(解析版) 题型:选择题
25℃时,下列有关溶液中微粒的物质的量浓度关系不正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B.pH =11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)> c(OH-)>c(H+)
C.0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH) = 0.1 mol·L-1
D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性: c(CH3COO-)>c(Cl-)
>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省苏州市高三9月学情调研化学试卷(解析版) 题型:选择题
下列物质性质与应用对应关系正确的是
A.漂白粉在空气中不稳定,可用于漂白纸张
B.医用酒精能使蛋白质变性,可用于消毒杀菌
C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
D.铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:填空题
在稀氨水中存在下述电离平衡NH3+H2O NH3 ·H2O
NH3 ·H2O NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
c(OH-)的变化 |
|
|
|
平衡移动方向 |
|
|
|
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
一种海水电池的反应原理可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,有关该反应的说法正确的是
A.反应中MnO2是还原剂
B.Ag的还原性比Na2Mn5O10强
C.该反应中MnO2具有催化作用
D.每生成1 mol Na2Mn5O10转移1 mol电子
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
2013年6月11日我国成功发射了“神州十号”。这标志着中国人的太空时代又前进了一大步。发射“神十”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:
N2(g)+2O2(g)=2NO2(g);△H=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534 kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7 kJ/mol
B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3 kJ/mol
C.N2H4(g)+NO2(g)=3/2N2(g)+2H2O(l);△H=-1135.7 kJ/mol
D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com