
【题目】在给定条件下,下列选项所示的物质间转化均能一步实现的是
①Fe![]() FeCl3
FeCl3![]() Fe(OH)3
Fe(OH)3
②S ![]() SO2
SO2![]() H2SO4
H2SO4
③CaCO3![]() CaO
CaO![]() CaSiO3
CaSiO3
④NH3 ![]() NO2
NO2![]() HNO3
HNO3
⑤N2(g)![]() NH3(g)
NH3(g)![]() NaHCO3(s)
NaHCO3(s)
⑥Mg(OH)2![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
A.①③⑤B.①②④C.②③⑤D.①⑤⑥
【答案】A
【解析】
①铁在氯气中燃烧生成氯化铁,氯化铁与氢氧化钠反应生成氢氧化铁沉淀,转化能一步实现,故①选;
②S燃烧生成SO2,二氧化硫与水反应生成亚硫酸,不能生成硫酸,不能一步实现转化,故②不选;
③碳酸钙高温分解生成CaO,CaO与二氧化硅在高温下反应生成硅酸钙,均可一步实现转化,故③选;
④氨气催化氧化生成NO,不是生成二氧化氮,不能一步实现转化,故④不选;
⑤氮气和氢气在高温、高压、催化剂条件下产生氨气,氨气和二氧化碳气体通入饱和氯化钠中NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,得到碳酸氢钠晶体,能够一步实现转化,故⑤选;
⑥电解MgCl2(aq)生成氢气、氢氧化镁沉淀和氯气,不会生成金属镁,不能一步实现转化,故⑥不选;
物质间转化均能一步实现的是①③⑤,故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的 KCl 饱和溶液)
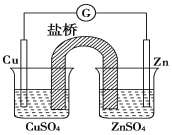
A.正极反应为 Zn- 2e- == Zn2+
B.取出盐桥后,检流计依然发生偏转
C.反应中,盐桥中的 K+会移向 CuSO4 溶液
D.电子从负极流向正极,再经盐桥流回负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,1molN2和3molH2催化反应后分子总数为2NA
B.100g98%的浓H2 SO4与过量的Cu反应后,电子转移数为NA
C.标准状况下,11.2L氧气和二氧化碳混合物中含氧原子数目为NA
D.1L1mol/LNa2CO3溶液中所含阴离子数目小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸亚铁可用作媒染剂、分析试剂、催化剂等。
(1)硝酸亚铁可用铁屑在低温下溶于稀硝酸制得,还原产物为NO。反应的化学方程式为________。
(2)某小组为探究硝酸亚铁晶体的热分解产物,按下图所示装置进行实验。
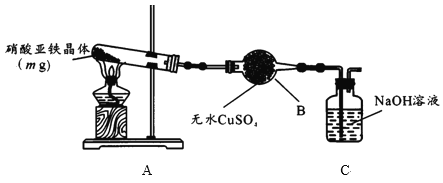
①仪器B的名称是____,实验中无水CuSO4变蓝,由此可知硝酸亚铁晶体含有___。
②实验中观察到A装置的试管中有红棕色气体生成,检验热分解后固体为氧化铁的实验方案为:
实验步骤 | 现象 |
取少量固体加适量稀硫酸,振荡,将溶液分成两份 | 固体溶解得黄色溶液 |
一份滴入____ | 溶液变成红色 |
另一份滴入1~2滴K3 [Fe(CN)6]溶液 | ___________ |
A中硝酸亚铁晶体[Fe(NO3)2·xH2O]分解的化学方程式为______ 。
(3)继续探究mg硝酸亚铁晶体中铁元素的质量分数
①取A中热分解后的固体放入锥形瓶,用稀硫酸溶解,加入过量的KI溶液,滴入2滴___作指示剂。
②用a mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液(已知:I2+2S2O32-=2I-+S4O62-),滴定至终点时用去bmLNa2S2O3溶液,则硝酸亚铁晶体中铁的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PHB是一种树脂,有机物K是一种抗惊厥药物,它们的合成路线如下:
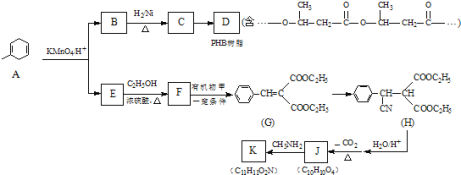
已知:R、R′、R″代表烃基
①RCN→H2O/H+RCOOH
②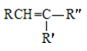
![]() RCOOH+
RCOOH+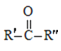
③
![]()
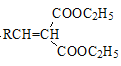 +H2O
+H2O
(1)B→C的反应类型是_____.
(2)写出一定条件下C→D的化学方程式_____:.
(3)有机物甲的结构简式为_____.
(4)写出E→F的化学方程式_____.
(5)已知1mol J最多与2mol NaHCO3反应;K分子结构中含有一个五元环与一个六元环.写出一定条件下J→K的化学方程式:_____.
(6)S是A的一种同分异构体,分子中没有环状结构,S的核磁共振氢谱有三个峰,峰面积之比为6:3:1,则S的结构简式为(写出一种即可)_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2的反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O.下列说法错误的是( )
MnCl2+Cl2↑+2H2O.下列说法错误的是( )
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 molCl2,转移电子的物质的量为2 mol
C. 每消耗1 molMnO2,起还原剂作用的HCl消耗4mol
D. 生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列说法正确的是
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
C.向盐酸中加入氨水至中性,溶液中c(NH4+)=c(Cl-)
D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:甲、乙、丙、丁为常见化合物,A、B为单质,相互转化关系如图。其中甲是天然气的主要成分。回答下列问题:
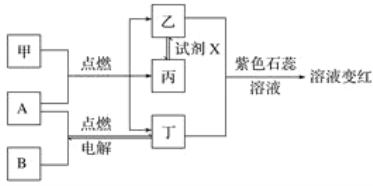
(1)丁物质的名称:______,丙物质的化学式:_________________________________________。
(2)检验化合物乙的化学方程式:___________________________________________________。
(3)试剂X可能的化学式:________、________(要求:所选物质类别不同)。
(4)通过分析表明:燃料充分燃烧的条件之一是______________________________。
(5)取变红溶液于试管中加热,观察到的现象有_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com