
【题目】下列变化需克服相同类型作用力的是
A. 碘和干冰的升华 B. 硅和C60的熔化
C. 氯化氢和氯化钾的溶解 D. 溴和汞的气化
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】某气态烃A,标准状况下的密度为1.25g/L。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,E有香味。它们之间的转化关系如下图所示:


(1)A的电子式为 ,D中官能团的名称为 。
(2)以A为原料自身合成高分子化合物的化学方程式为 ,反应类型是 。
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如右图所示)。观察到的现象是 ,重复操作2-3次。写出过程②反应方程式 。
(4)B、D在浓硫酸的作用下实现反应③,实验装置如下图所示:

①试管1中实现反应③的化学方程式为 ,
②反应开始时用酒精灯对试管小火加热的原因是: 。(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求写出和应的方程式
(1)Ca(OH)2的电离方程式__________
(2)FeCl3溶液中加入铜粉的离子方程式__________
(3)碳酸氢钙与过量氢氧化钠溶液反应的离子方程式__________
(4)FeBr2溶液中加入足量氯水的离子方程式__________
(5)浓硝酸与铜反应的离子方程式__________
(6)过量铁粉与稀硝酸反应的离子方程式__________
(7)氯化铁溶液与偏铝酸钠溶液混合反应的离子方程式__________
(8)氯化铝的水溶液充分加热反应的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH―=NH3↑+H2O
B.用惰性电极电解饱和氯化钠溶液:2Cl―+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
C.向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I―=2Fe2++I2
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32―+6H++2MnO4―=5SO42―+2Mn2++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Al2(SO4)3溶液V mL中含a g Al3+,取出V/4 mL溶液稀释成4V mL后,SO42-的物质的量浓度为( )
A.125/54V mol·L-1 B.125a/36V mol·L-1
C.125a/18V mol·L-1 D.125a/V mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V L浓度为0.5 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
A.通入标准状况下的HCl气体11.2V L
B.加入10 mol·L-1的盐酸0.1V L,再稀释至1.5V L
C.将溶液加热浓缩到0.5V L
D.加入V L 1.5 mol·L-1的盐酸混合均匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的甲烷和氯气组成的混和气体,经较长时间的光照,最后得到的有机物是( ) ①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4
A.只有① B.只有② C.只有①②③ D.①②③④都有
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应Z(?)+W(?)![]() X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
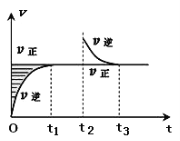
A.Z和W在该条件下至少有一个是为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C.若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
D.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com