

| 1 |
| 3 |
| 0.6mol |
| 0.1L |
| 0.4mol |
| 0.1L |


科目:高中化学 来源: 题型:
| A、氢化物的沸点:HF<HCl<HBr<HI |
| B、CaF2、CaCl2、CaBr2、CaI2的溶解性依次减小 |
| C、AgF、AgCl、AgBr、AgI的溶解性依次减小 |
| D、F2、Cl2、Br2、I2氧化性逐渐减弱,都能与Fe反应生产Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热、加压 |

| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol?L-1 | 0.44 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
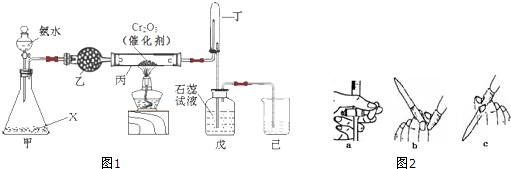
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失 |
| B、锥形瓶用蒸馏水洗净后,未经干燥即进行滴定 |
| C、滴定过程中,锥形瓶中有溶液溅出 |
| D、酸式滴定管未用标准盐酸润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com