
| C |
| D |
| C |
| D |
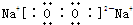 ,
,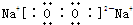 ;
;

科目:高中化学 来源: 题型:
 X、Y、Z、W为短周期元素,它们在周期表的位置如图所示,若Y原子的最外层电子数是内层电子数的3倍.下列说法中错误的是( )
X、Y、Z、W为短周期元素,它们在周期表的位置如图所示,若Y原子的最外层电子数是内层电子数的3倍.下列说法中错误的是( )| A、X的氢化物的水溶液显碱性 |
| B、Y和Z只能组成一种化合物 |
| C、Z的氧化物和Z的氢化物分别溶于水后,溶液均呈酸性 |
| D、最高价氧化物对应水化物的酸性:W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
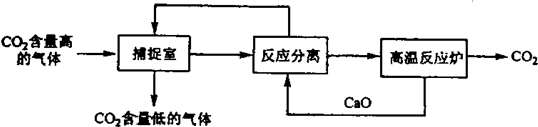
| A、能耗大是该方法的一大缺点 |
| B、整个过程中,既有氧化还原反应又有非氧化还原反应 |
| C、“反应分离”环节中,分离的基本操作是过滤 |
| D、整个过程中,有2种物质可以循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
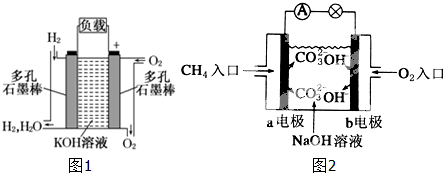
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 混合溶液 |
A | B | C | D | E | F |
| 4mol?L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸浸泡 |
| 过滤 |
| 氧化处理 |
| 足量的 |
| NaOH溶液 |
| 过滤 |
| 洗涤 |
| 煅烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com