
【题目】已知X、Y、Z都是元素周期表中前四周期的元素,他们的原子序数依次增大,并且不在同一个周期。元素X的原子核外有8个运动状态不同的电子。元素Y基态原子的最外电子层没有空轨道,而且成对电子数是未成对电子数的2倍。元素Z基态原子的内层轨道全部排满电子,且最外层电子数为2。
(1)基态X原子的核外电子排布图(轨道表达式)为_________,X的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是________________________。
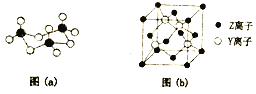
(2)X与Y形成的固体YX3中存在(a)所示的三聚分子,该分子中Y原子的杂化轨道类型为_______。基态Y原子中,核外能级最高的原子轨道上,具有的电子数为______。
(3)X与Y还可以形成YX42-离子,YX42-的空间构型为_________,写出一种与YX42-互为等电子体的分子的化学式________。
(4)Z与Y的离子形成化合物晶体的晶胞如图(b)所示。在晶胞中,Z离子的配位数为_________,该化合物的化学式为______。
(5)Z的氯化物与氨水反应可形成配合物[Z(NH3)4]Cl2,1mol该配合物中含有![]() 键的数目为_______。
键的数目为_______。
【答案】 水分子与乙醇分子之间形成氢键 sp3 4 正四面体 CCl4或SiCl4等 4 ZnS 16NA
水分子与乙醇分子之间形成氢键 sp3 4 正四面体 CCl4或SiCl4等 4 ZnS 16NA
【解析】
元素X的原子核外有8个运动状态不同的电子,则X是8号O元素;元素Y基态原子的最外电子层没有空轨道,而且成对电子数是未成对电子数的2倍,则Y是S元素;元素Z基态原子的内层轨道全部排满电子,且最外层电子数为2,Z是Zn元素。据此分析解答。
根据上述分析可知X是O元素,Y是S元素,Z是Zn元素。
(1)根据原子构造原理,结合泡利不相容原理和可知基态O原子的核外电子排布图为 ;由于O原子半径小,元素的非金属性强,H2O中的共价键的共用电子对偏向O原子一方,使H几乎成为裸露的质子,因此导致水分子与乙醇分子之间形成氢键,增加了分子之间的吸引力,因此水容易溶于乙醇,而H2S分子与乙醇分子之间没有氢键的存在,在乙醇在溶解度很小;
;由于O原子半径小,元素的非金属性强,H2O中的共价键的共用电子对偏向O原子一方,使H几乎成为裸露的质子,因此导致水分子与乙醇分子之间形成氢键,增加了分子之间的吸引力,因此水容易溶于乙醇,而H2S分子与乙醇分子之间没有氢键的存在,在乙醇在溶解度很小;
(2)S原子与O原子形成三聚分子,每个S原子与4个O原子形成共价键,且不含孤电子对,根据价层电子对互斥理论可知SO3中S原子杂化轨道类型为sp3杂化;基态Y原子的核外电子排布式是1s22s22p63s23p4,可见其能级最高的原子轨道是3p轨道,该轨道上具有的电子数为4个;
(3)X与Y还可以形成SO42-离子,在SO42-离子中S原子的价层电子对数为:4+![]() =4,且不含孤电子对,根据价层电子对互斥理论可知SO42-离子的空间构型为正四面体,根据等电子体的含义可知与SO42-互为等电子体的分子的化学式可能为CCl4或SiCl4等;
=4,且不含孤电子对,根据价层电子对互斥理论可知SO42-离子的空间构型为正四面体,根据等电子体的含义可知与SO42-互为等电子体的分子的化学式可能为CCl4或SiCl4等;
(4)根据S与Zn的离子形成化合物晶体的晶胞结构可知:在晶胞中,Z离子的配位数为4,在一个晶胞中含有Zn:![]() ,含有S原子数为4,Zn:S=1:1,所以该化合物的化学式为ZnS;
,含有S原子数为4,Zn:S=1:1,所以该化合物的化学式为ZnS;
(5)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2中,在一个配位体中含有3个σ键,四个配位体共含有4×3=12个,还有NH3中的N原子与Zn2+形成的四个配位键也属于σ键,因此1个[Zn(NH3)4]Cl2中含有的σ键为12+4=16个,则1mol该配合物中含有σ键的数目为16NA。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出实验过程中总的化学方程式______________;在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是_______反应。(填“吸热”或“放热”).
(2)甲是热水浴,乙是冷水浴,但两个水浴作用不相同,①甲的作用是___________;②乙的作用是____________________________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有___________ 。要除去该物质,可先在混合液中加入__________(填写字母),然后再通过蒸馏即可除去。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/ g·mL-1 | 其他 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2(少量) |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
(一)制备
如图是实验室制备PCl3的装置(部分仪器已省略)。

(1)仪器乙的名称是________;其中,与自来水进水管连接的接口编号是________。(填“a”或“b”)
(2)实验室制备Cl2的离子方程式___________________________。实验过程中,为减少PCl5的生成,应控制____________。
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解,影响产品的纯度;二是_________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是________。
(二)分析
测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.100 0 mol·L-1 20.00 mL碘溶液,充分反应后再用0.100 0 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2===H3PO4+2HI;I2+2Na2S2O3===2NaI+Na2S4O6;假设测定过程中没有其他反应。
(5)根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为________。若滴定终点时俯视读数,则PCl3的质量分数________(填“偏大”“偏小”或“无影响”)。
(三)探究
(6)设计实验证明PCl3具有还原性:_____________________________________。(限选试剂有:蒸馏水、稀盐酸、碘水、淀粉)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,2018年是合成氨工业先驱哈伯(P·Haber)获得诺贝尔奖100周年
(1)合成氨反应是一个可逆反应:N2(g)+3H2(g)![]() 2NH3(g),已知298K时:ΔH=-92.2kJ/mol,ΔS=-198.2J/(K·mol),则根据正反应的焓变和熵变分析,常温下合成氨反应____(填“能”或“不能”)自发进行。实验研究表明,在特定条件下,合成氨反应的速率与参加反应的物质的浓度的关系式如下,v=kc(N2)c1.5(H2)c-1(NH3),k为速率常数,请根据该关系式分析,如果想增大合成氨反应的速率,从浓度的角度可以采用的措施为________。根据合成氨反应的特点,请再说出一项能够提高合成氨反应速率的措施_________。
2NH3(g),已知298K时:ΔH=-92.2kJ/mol,ΔS=-198.2J/(K·mol),则根据正反应的焓变和熵变分析,常温下合成氨反应____(填“能”或“不能”)自发进行。实验研究表明,在特定条件下,合成氨反应的速率与参加反应的物质的浓度的关系式如下,v=kc(N2)c1.5(H2)c-1(NH3),k为速率常数,请根据该关系式分析,如果想增大合成氨反应的速率,从浓度的角度可以采用的措施为________。根据合成氨反应的特点,请再说出一项能够提高合成氨反应速率的措施_________。
(2)研究表明,在Fe催化剂作用下合成氨的反应历程为(*表示吸附态):
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+H*![]() NH*;NH*+H*
NH*;NH*+H*![]() NH2*;NH2*+H*
NH2*;NH2*+H*![]() NH3*
NH3*
脱 附:NH3*![]() NH3(g)
NH3(g)
其中,N2的吸附分解反应速率慢,解决了合成氨的整体反应速率。
实际生产中,合成氨常用工艺条件:Fe作催化剂,控制温度773K,压强3.0×107Pa,原料中N2和H2物质的量之比为1:2.8。请回答:
①分析说明原料中N2过量的理由____________。
②近年来,中国科学院大连化学物理研究所陈平研究团队经过近二十年的积累,先后在催化剂分解、催化氨合成、化学链合成氨等方面取得重要进展。关于合成氨工艺的下列理解,正确的是______。
A.人们对合成氨研究的重要目的之一是要实现氨的低温高效合成
B.控制温度(773K)远于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.陈平团队首次报道了具有优异低温活性的LiH-3d过渡金属这一复合催化剂体系,它可以大大提高反应的平衡转化率
D.N2的吸附分解反应活化能高,是合成氨反应条件苛刻的重要原因
E.陈平团队构建了一条基于可再生能源的化学链合成氨工艺流程,可以显著提高能效
(3)若N2和H2生成NH3的反应为:![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g),的标准平衡常数
NH3(g),的标准平衡常数 ,其中
,其中![]() 为标准大气压(1×105Pa),
为标准大气压(1×105Pa),![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如P(NH3)=x(NH3) P,P为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。
为各组分的平衡分压,如P(NH3)=x(NH3) P,P为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为![]() ,则
,则![]() _________(用含
_________(用含![]() 的最简式表示)
的最简式表示)
②根据合成氨反应的特点,标准平衡常数![]() 随温度T升高而逐渐______(填“增大”或“减小”)。
随温度T升高而逐渐______(填“增大”或“减小”)。
(4)希腊两位科学家曾经采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶体薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。钯电极A为______极(填“阴”或“阳”),该极上的电极反应式是___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组,将一包白色粉末(NaHCO3和Na2CO3的混合物)进行定量分析。现称取一份质量为27.4 g的样品,将此样品加热灼烧至质量不再变化,取出剩余物质,冷却后称重,质量为21.2g。
(1)写出加热时发生反应的化学方程式:___。
(2)分别求出该样品中NaHCO3和Na2CO3的物质的量。____、____(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
B. Na2O2与CO2反应生成0.1 mol O2时转移电子0.4 mol
C. Na2O2投入到CuCl2溶液中有蓝色沉淀及气泡产生
D. 向饱和烧碱溶液中加入2 g Na2O2,充分反应完后,溶液中c(Na+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实用性很强的科学。根据题意填空:
(1)古代锻造刀剑时,将炽热的刀剑快速投入水中“淬火”,反应为:3Fe+4H2O(g) ![]() Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
(2)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有________(填“钠”或“钾”)元素;
(3)海水提镁的重要步骤之一是用沉淀剂将海水中的Mg2+沉淀。该沉淀剂是__________(填“生石灰”或“盐酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应下列叙述不正确的是
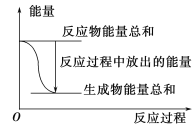
A. 反应过程中能量关系可用上图表示
B. ΔH的值与反应方程式的计量系数有关
C. 若将该反应设计成原电池,锌为负极
D. 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是化学学习的重要内容。根据你掌握的知识,完成下面内容。
(1)实验室需要1mol·L-1NaOH溶液245mL,请回答下列问题:
①为了配制此溶液应选择____mL的容量瓶,用天平称取____g NaOH。
②溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移会使溶液的浓度____(填“偏大”或“偏小”,下同);在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,洗涤液若不转移入容量瓶,会导致溶液的浓度____。
③当溶质完全转移至容量瓶后,需要确定溶液的容积,我们称之为定容。定容时,先直接加水至刻度下1~2cm处,改用___加水至溶液凹液面与刻度线相切。
(2)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液 B.升华 C.结晶 D.过滤 E.蒸馏 F.分液
①分离饱和食盐水与沙子的混合物____;
②从碘水中提取碘单质____;
③分离水和汽油的混合物___;
④分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com