
| A. | $\overline{v}$(O2)=0.3 mol•L-1•s-1 | B. | $\overline{v}$(NO)=0.24mol•L-1•s-1 | ||
| C. | $\overline{v}$(NH3)=0.12 mol•L-1•s-1 | D. | $\overline{v}$(H2O)=0.36mol•L-1•min-1 |
分析 30秒后NH3的物质的量减少了0.6mol,则$\overline{v}$(NH3)=$\frac{\frac{0.6mol}{5L}}{30s}$=0.004 mol•L-1•s-1,结合速率之比等于化学计量数之比计算.
解答 解:30秒后NH3的物质的量减少了0.6mol,则$\overline{v}$(NH3)=$\frac{\frac{0.6mol}{5L}}{30s}$=0.004 mol•L-1•s-1,
由4NH3+5O2?4NO+6H2O及速率之比等于化学计量数之比可知,
$\overline{v}$(O2)=0.004 mol•L-1•s-1×$\frac{5}{4}$=0.005mol•L-1•s-1,
$\overline{v}$(NO)=$\overline{v}$(NH3)=0.004mol•L-1•s-1,
$\overline{v}$(H2O)=0.004 mol•L-1•s-1×$\frac{6}{4}$=0.006mol•L-1•s-1=0.36mol•L-1•min-1,
故选D.
点评 本题考查反应速率与化学计量数的关系,为高频考点,把握速率之比等于化学计量数之比为解答的关键,侧重分析与计算能力的考查,注意速率公式及单位,题目难度不大.


科目:高中化学 来源: 题型:选择题
 ,则原有机物一定是( )
,则原有机物一定是( )| A. | 1,3-丁二烯 | B. | 2-甲基-1,3-丁二烯 | ||
| C. | 2-丁炔 | D. | 1,4-二氯-2-甲基-2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阅读下列信息,完成下列各题
阅读下列信息,完成下列各题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
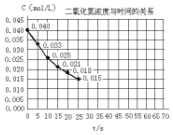 二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.
二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
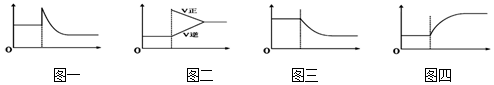
| A. | 可逆反应:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硫酸,溶液变橙色,氢离子浓度随时间变化曲线如图一 | |
| B. | 可逆反应Co(H2O)62+(粉红色)+4Cl-?CoCl42- (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如图二 | |
| C. | 可逆反应:2NO2?N2O4达平衡状态呈红棕色,加压红棕色变深,NO2物质的量随时间变化曲线如图三 | |
| D. | 可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如图四 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com