
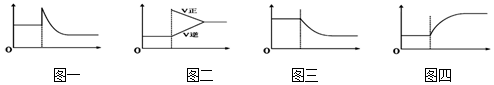
| A. | 可逆反应:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硫酸,溶液变橙色,氢离子浓度随时间变化曲线如图一 | |
| B. | 可逆反应Co(H2O)62+(粉红色)+4Cl-?CoCl42- (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如图二 | |
| C. | 可逆反应:2NO2?N2O4达平衡状态呈红棕色,加压红棕色变深,NO2物质的量随时间变化曲线如图三 | |
| D. | 可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如图四 |
分析 A.图象分析可知加入氢离子浓度增大后随平衡左移,氢离子浓度减小,但比开始的平衡浓度大;
B.温度升高,增大正逆反应速率,吸热反应方向速率增大的大,逆反应速率比原来平衡状态的大;
C.平衡体系加压,体积缩小,浓度增大,平衡随压强增大向气体体积减小的方向进行,二氧化氮物质的量减小;
D.反应是放热反应,升温平衡逆向进行,氨气的体积分数减小.
解答 解:A.图象分析可知加入氢离子,浓度增大,平衡逆向进行,随平衡左移,氢离子浓度减小,达到新平衡状态比开始的平衡浓度大,故A错误;
B.温度升高,增大正逆反应速率,吸热反应方向速率增大的大,逆反应速率比原来平衡状态的大,图象中逆反应速率是原平衡状态的速率,将V逆向上提一部分,与原横线分开一段,故B错误;
C.平衡体系加压,体积缩小,浓度增大,平衡随压强增大向气体体积减小的方向进行,平衡正向进行,二氧化氮物质的量减小,故C正确;
D.反应是放热反应,升温平衡逆向进行,氨气的体积分数减小,图象中氨气的体积分数变化错误,故D错误;
故选C.
点评 本题考查图象分析方法,为高考常见题型和高频考点,侧重于学生的分析能力的考查,化学平衡移动原理和化学反应速率影响因素的分析是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | $\overline{v}$(O2)=0.3 mol•L-1•s-1 | B. | $\overline{v}$(NO)=0.24mol•L-1•s-1 | ||
| C. | $\overline{v}$(NH3)=0.12 mol•L-1•s-1 | D. | $\overline{v}$(H2O)=0.36mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 所含硫原子的物质的量之比为1:1 | B. | 硫元素的质量之比为5:4 | ||
| C. | 氧元素的质量之比为5:6 | D. | 所含氧原子的物质的量之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cl-、SO42-、K+ | B. | K+、Cu2+、SO42-、NO3- | ||
| C. | K+、H+、HCO3-、Cl- | D. | Mg2+、Cl-、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将 100mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA | |
| B. | 通常状况下,0.5 mol锌粒与足量盐酸反应产生11.2 L H2 | |
| C. | 常温常压下,2.4g金属镁变成镁离子时,失去的电子数为0.1NA | |
| D. | 标准状况下,22.4L由N2和N2O组成的混合气体中,所含N原子的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
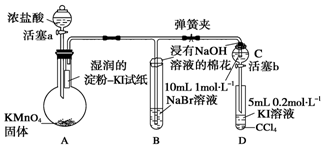
 ;A中发生的反应的化学反应方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O.
;A中发生的反应的化学反应方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com