
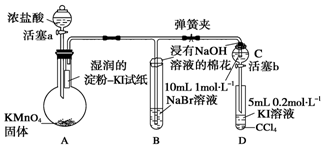
 ;A中发生的反应的化学反应方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O.
;A中发生的反应的化学反应方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O.分析 验证卤素单质氧化性的相对强弱,装置A:高锰酸钾溶液和浓盐酸反应生成氯化锰、氯化钾、氯气和水,装置A中生成氯气,烧瓶上端湿润的碘化钾淀粉试纸变蓝色,验证氯气的氧化性强于碘,装置B:装置B中盛有溴化钠,氯气进入装置B中,氯气氧化溴离子为溴单质,溶液呈橙红色,验证氯的氧化性强于溴,氯气有毒,能被氢氧化钠吸收,浸有氢氧化钠的棉花防止氯气污染空气,当B和C中的溶液都变为黄色时,夹紧弹簧夹,为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,以此解答该题.
解答 解:(1)黄绿色气体为氯气,由高锰酸钾和浓盐酸发生氧化还原反应生成,反应的化学方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O,氯气中存在1对氯氯共用电子对,氯原子最外层达到8电子稳定结构,电子式为: ,
,
故答案为: ;2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O;
;2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O;
(2)淀粉变蓝色,说明有单质碘生成,说明氯气氧化性强于单质碘,
故答案为:A中湿润的淀粉-KI试纸变蓝;
(3)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成,发生反应的离子方程式为:Cl2+2Br-═Br2+2Cl-,
故答案为:Cl2+2Brˉ═Br2+2Clˉ;
(4)为验证溴的氧化性强于碘,应将C中生成的溴加入到盛有KI溶液的D中,如发生氧化还原反应,则静至后CCl4层溶液变为紫红色,
故答案为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D充分振荡,静置后CCl4层溶液变为紫色;
(5)为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,
故答案为:保证C中的黄色溶液无Cl2,排除Cl2对溴置换碘实验的干扰;
(6)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强,得电子能力逐渐减弱,
故答案为:减弱;原子半径逐渐增大;减弱.
点评 本题主要考查了卤素单质氧化性的相对强弱的验证,为高频考点,侧重于学生的分析能力和实验能力的考查,根据实验现象并用卤素性质进行解释是解答关键,注意要排除干扰因素的存在,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
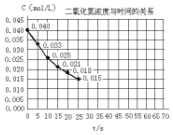 二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.
二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8molNaCl所含离子数 | B. | 标准状况下5.6L CO2所含原子数 | ||
| C. | 1L1 mol•L-1盐酸溶液所含H原子数 | D. | 10g氖气所含原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
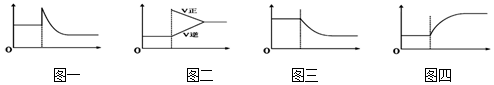
| A. | 可逆反应:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硫酸,溶液变橙色,氢离子浓度随时间变化曲线如图一 | |
| B. | 可逆反应Co(H2O)62+(粉红色)+4Cl-?CoCl42- (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如图二 | |
| C. | 可逆反应:2NO2?N2O4达平衡状态呈红棕色,加压红棕色变深,NO2物质的量随时间变化曲线如图三 | |
| D. | 可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如图四 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高 | B. | 降 低 | C. | 不变 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com