
分析 (1)根据元素的化合价的变化判断还原剂和氧化剂,氧化还原反应反应中氧化剂氧化性大于氧化产物的氧化性,以此比较氧化性强弱;
(2)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,Cl元素的化合价升高,以此来解答.
解答 解:(1)反应①中Cu化合价升高,被氧化,为还原剂,由反应①可知氧化性Fe3+>Cu2+,由反应②可知氧化性Cu2+>Fe2+,则氧化性Fe3+>Cu2+>Fe2+,
故答案为:Cu;Fe3+>Cu2+>Fe2+;
(2)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,则MnO2为氧化剂,生成MnCl2为还原产物,Cl元素的化合价升高,则HCl为还原剂,生成Cl2为氧化产物,故答案为:HCl;MnO2;MnCl2;Cl2.
点评 本题考查氧化还原反应,侧重于概念的理解,为高考高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 汽车制造商:车的外形变得美观,能够提高销量;易于加工,降低成本 | |
| B. | 车主:车的重量减轻,油耗降低;汽车价格便宜 | |
| C. | 意外被保险杠撞到的行人:具有缓冲作用,减轻伤害 | |
| D. | 旁观者:用塑料作保险杠不安全 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 离子方程式 | |
| ①KCl (K2SO4) | ||
| ②Na2SO4 (MgSO4) | ||
| ③NaCl (Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度:H++OH-═H2O | |
| B. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2Na++2OH-═Na2SiO3+H2O | |
| C. | 利用铝热反应焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| D. | 用氯水除去FeCl2溶液中的Fe2+:Cl2+Fe2+═2Cl-+Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 所含硫原子的物质的量之比为1:1 | B. | 硫元素的质量之比为5:4 | ||
| C. | 氧元素的质量之比为5:6 | D. | 所含氧原子的物质的量之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的电化学腐蚀比化学腐蚀更普遍 | |
| B. | 在铁板表面涂抹油漆,不能防止铁板被腐蚀 | |
| C. | 钢铁在干燥空气中不易被腐蚀 | |
| D. | 用牺牲锌块的方法来保护船身 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cl-、SO42-、K+ | B. | K+、Cu2+、SO42-、NO3- | ||
| C. | K+、H+、HCO3-、Cl- | D. | Mg2+、Cl-、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
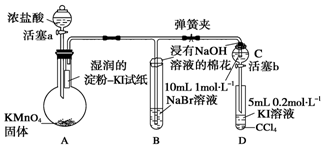
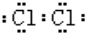 ;A中发生的反应的化学反应方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O.
;A中发生的反应的化学反应方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com