

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
| B | 17.9 | 290 | 1.26 |
分析 (1)A名称是蒸馏烧瓶;碎瓷片能防止混合溶液剧烈沸腾;图1为蒸馏装置,图2为分液装置、图3为过滤装置、图4为蒸发装置,结合实验操作及实验注意事项分析;
(2)A、B互溶,但沸点差异大.
解答 解:(1)由图1可知,A为蒸馏烧瓶,B为冷凝管,A 中一般要加入碎瓷片,其作用是防暴沸,
A.图1实验中,加热一段时间后发现未加入碎瓷片,应冷却后再添加,以防发生危险,故错误;
B.图2实验中,应打开活塞,若有机溶剂在上层,则将有机溶剂从上端倒出,故错误;
C.图3实验中,玻璃棒不能在漏斗中搅拌,易捣破滤纸,故错误;
D.图4实验中,当加热至有较多固体析出时,即停止加热,可利用余热加热,操作合理,故D正确;
故答案为:蒸馏烧瓶;冷凝管;防暴沸;D;
(2)A、B互溶,但沸点差异大,则利用蒸馏可分离,选图1装置,故答案为:1.
点评 本题考查物质的分离、提纯的方法及选择,为高频考点,把握装置图及物质的性质差异性为解答的关键,侧重实验基本技能和基础知识的考查,会根据物质性质正确选取合适的分离提纯仪器.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
| 试剂 | 离子方程式 | |
| ①KCl (K2SO4) | ||
| ②Na2SO4 (MgSO4) | ||
| ③NaCl (Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cl-、SO42-、K+ | B. | K+、Cu2+、SO42-、NO3- | ||
| C. | K+、H+、HCO3-、Cl- | D. | Mg2+、Cl-、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
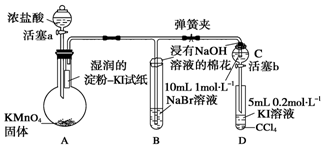
 ;A中发生的反应的化学反应方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O.
;A中发生的反应的化学反应方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图 | |
| B. | S2-的结构示意图: | |
| C. | 纯碱的化学式:NaHCO3 | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com