
����Ŀ���������ʵ���������ͭ�Ļ����24g ��600mLϡ����ǡ����ȫ��Ӧ������NO 6.72L(��״��)����Ӧ�����Һ�м���1mol��L��1 NaOH��Һʹ��������ǡ�ó��������ˡ������й�˵���������( )
A. ������ܽ�����Һ��c(Fe3+):c(Fe2+)=1:1 B. ϡ��������ʵ���Ũ����2 mol��L��1
C. �����NaOH��Һ1000mL D. ������ó����ڿ����г�ּ��ȿɵù���32g
���𰸡�C
��������
�����ʵ���������ͭ��ϣ�ƽ��Ħ������Ϊ![]() =60g/mol������ͭ�Ļ����24g�����ʵ���֮��Ϊ
=60g/mol������ͭ�Ļ����24g�����ʵ���֮��Ϊ![]() =0.4mol�������к���0.2mol����0.2molͭ��6.72L(��״��)NO �����ʵ���Ϊ��
=0.4mol�������к���0.2mol����0.2molͭ��6.72L(��״��)NO �����ʵ���Ϊ��![]() =0.3mol������0.4mol������ͭ�Ļ���ﹲת��0.3mol��3=0.9mole-��������������0.9mol��A�������ȫ���������������ת��0.2��3+0.2��2=1mole-��������һ������ת��Ϊ�������ӣ����������ӵ����ʵ���Ϊxmol����������Ϊ(0.2-x)mol������ת�Ƶĵ�����Ŀ��ȣ���֪2x+3(0.2-x)=0.9-0.4������x=0.1mol�����Ի�����ܽ�����Һ��c(Fe3+)��c(Fe2+)=1��1����A��ȷ��B����Ӧ����������������������������ͭ�Լ�NO���壬����Nԭ���غ㣬��������ʵ���Ũ����
=0.3mol������0.4mol������ͭ�Ļ���ﹲת��0.3mol��3=0.9mole-��������������0.9mol��A�������ȫ���������������ת��0.2��3+0.2��2=1mole-��������һ������ת��Ϊ�������ӣ����������ӵ����ʵ���Ϊxmol����������Ϊ(0.2-x)mol������ת�Ƶĵ�����Ŀ��ȣ���֪2x+3(0.2-x)=0.9-0.4������x=0.1mol�����Ի�����ܽ�����Һ��c(Fe3+)��c(Fe2+)=1��1����A��ȷ��B����Ӧ����������������������������ͭ�Լ�NO���壬����Nԭ���غ㣬��������ʵ���Ũ����![]() =2molL-1����B��ȷ��C�������NaOH��Һ�����Ϊ��
=2molL-1����B��ȷ��C�������NaOH��Һ�����Ϊ��![]() =0.9L=900mL����C����D��������ó����ڿ����г�ּ��ȿɵ�������������ͭ�Ĺ����������Ϊ��0.1mol��160g/mol+0.2mol��80 g/mol =32g����D��ȷ����ѡC��
=0.9L=900mL����C����D��������ó����ڿ����г�ּ��ȿɵ�������������ͭ�Ĺ����������Ϊ��0.1mol��160g/mol+0.2mol��80 g/mol =32g����D��ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ұ���������ѧ������������ǵ�ת����ϵ��ͼ��ʾ��ijЩ�����Ͳ��ֲ�������ȥ��������˵���������

A. ����Ϊһ��ǿ������ɫ��ӦΪ��ɫ����Ӧ�٢ڿ��ܶ�����������ԭ��Ӧ
B. �����£�����Ϊ��ɫ���壬��Ϊ����ɫ���壬��ס��ҿ�����ͭ��ϡ����
C. ����Ϊ���ȼ�ղ����Ϊˮ�����첻�����ڸ����
D. ����ΪŨ���ᣬ��ΪMnO2���������ʹƷ����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Һ����������÷�Һ©���������
A.�Ҵ���ˮB.�������ˮ
C.��������ȷ�D.�����屽
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�������˵���У���ȷ����
A.���Ļ�ѧ���ʲ�����
B.�������ᡢ�Ӧ
C.������������������Ӧ
D.��������������һ�����ܵ�����������Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�������̿�(��Ҫ�ɷ���MnO2������SiO2��Fe2O3����������)Ϊ��Ҫԭ���Ʊ������ܵĴ��Բ���̼����(MnCO3)���乤ҵ��������ͼ��ʾ��
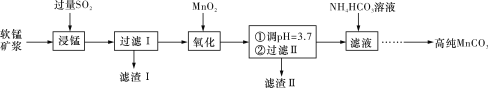
��1�������ˢ����á���������Ҫ�ɷ�Ϊ_________(�ѧʽ)��
��2���������������г��˷���MnO2��SO2�ķ�Ӧ�⣬��������һ������ԭ��Ӧ��д���÷�Ӧ�����ӷ���ʽ______________________________________________________________��
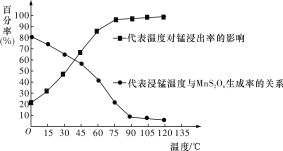
��3�������̡���Ӧ�������и�����MnS2O6���ɣ��¶ȶԡ����̡���Ӧ��Ӱ����ͼ��ʾ��Ϊ����MnS2O6�����ɣ������̡��������¶���____________________________________��
��4�����ˢ����õ���Һ�м���NH4HCO3��Һʱ�¶ȿ�����30��35 �棬�¶Ȳ���̫�ߵ�ԭ����_________________________________________________________________��
��5������NH4HCO3��Һ������MnCO3������ͬʱ����CO2�������ɣ�д����Ӧ�����ӷ���ʽ��_____________________________________________________________________��
��6�����ɵ�MnCO3�����辭���ϴ�ӣ���������Ƿ�ϴ�Ӹɾ��ķ�����___________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ����ʹ����ȷ����
A. ����������Ϊ117��������Ϊ174�ĺ���Ts�ɱ�ʾΪ��![]()
B. ������ӵı���ģ�ͣ� ![]()
C. COCl2�ĽṹʽΪ��![]()
D. H2O2�ĵ���ʽΪ��H+[ ![]() ]2-H+
]2-H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������д��ȷ����
A. H2(g)+F2 (g)===2HF(g) ��H=-270 kJ��mol -1������ͬ�����£�2mol HF�������������1mol������1mol����������֮��
B. 2H2(g)+O2(g)===2H2O(g) ��H=-483.6kJ��mol-1,��������ȼ���ȴ���241.8kJ.mol-1
C. ��20.0gNaOH��ϡ��Һ��ϡ������ȫ�к�,�ų�28.7kJ������,���ʾ���кͷ�Ӧ���Ȼ�ѧ����ʽΪNaOH+HCl===NaCl+H2O ��H =-57.4kJ��mol-1
D. 500�桢30MPaʱ,������ӦN2(g)+3H2(g) ![]() 2NH3(g) ��H =-38.6kJ��mol-1�ڴ������½�1.5molH2����N2��ַ�Ӧ,�ų�����19.3kJ
2NH3(g) ��H =-38.6kJ��mol-1�ڴ������½�1.5molH2����N2��ַ�Ӧ,�ų�����19.3kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A.һ�������¿�����H2��ȥ�����л��е���ϩ
B.�������Ȼ�̼������ȡ��ˮ�е���
C.�Ҵ�������������������ߵĻ��Һ���÷�Һ�ķ�������
D.���顢��ϩ�ͱ��ڹ�ҵ�϶���ͨ��ʯ�ͷ���õ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������У�������Ӧ3A��g��+B��g��![]() 2Z��g���������A�����ʵ���Ũ����2mol/L�����10s��A��ƽ����Ӧ���ʦԣ�A��=0.15mol/��Ls������Ӧ���е�10sʱ������A�����ʵ���Ũ����
2Z��g���������A�����ʵ���Ũ����2mol/L�����10s��A��ƽ����Ӧ���ʦԣ�A��=0.15mol/��Ls������Ӧ���е�10sʱ������A�����ʵ���Ũ����
A. 3mol/L B. 1.2 mol/L C. 0.5mol/L D. 3.5 mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com