
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下图所示:
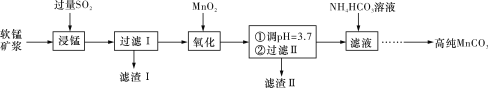
(1)“过滤Ⅰ”所得“滤渣Ⅰ”的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式______________________________________________________________。
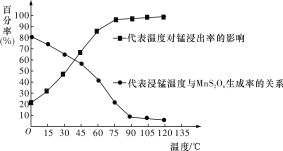
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是____________________________________。
(4)向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是_________________________________________________________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________________________________________________________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是___________________________________________________________________________。
【答案】SiO2 2Fe2++MnO2+4H+===2Fe3++Mn2++2H2O 90℃ 防止NH4HCO3受热分解,提高原料的利用率 Mn2++2HCO3-===MnCO3↓+CO2↑+H2O 取1~2mL最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净
【解析】
软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3):由流程可以知道软锰矿形成矿浆,通入足量的SO2,发生反应,MnO2+SO2=MnSO4,Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,SiO2不反应,过滤,滤渣I为,滤液含有Mn2+、Fe2+,加入二氧化锰氧化亚铁离子,反应为:2Fe2++MnO2+4H+===2Fe3++Mn2++2H2O,调节pH,沉淀铁离子,过滤,滤渣II为氢氧化铁,向滤液中加入碳酸氢铵溶液,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,反应为:Mn2++2HCO3-===MnCO3↓+CO2↑+H2O,通过洗涤、烘干得到MnCO3晶体,据此分析解答。
(1)软锰矿形成矿浆,通入足量的SO2,MnO2、Fe2O3与O2反应生成Mn2+、Fe2+,SiO2不反应,过滤,滤渣I为SiO2,
因此,本题正确答案是:SiO2;
(2) 加入二氧化锰氧化亚铁离子,反应为:2Fe2++MnO2+4H+===2Fe3++Mn2++2H2O,
因此,本题正确答案是:2Fe2++MnO2+4H+===2Fe3++Mn2++2H2O;
(3)由图可以知道,90℃时,MnS2O6的生成率低,锰浸出率高,温度再高,变化不大,则“浸锰”的适宜温度是90℃,
因此,本题正确答案是:90℃;
(4) NH4HCO3受热易分解,温度不宜太高,防止NH4HCO3受热分解,提高原料利用率,
因此,本题正确答案是:防止NH4HCO3受热分解,提高原料利用率;
(5) Mn2+的滤液中加入NH4HCO3溶液后,发生彻底的双水解,生成MnCO3沉淀和二氧化碳,反应为:Mn2++2HCO3-===MnCO3↓+CO2↑+H2O;
因此,本题正确答案是:Mn2++2HCO3-===MnCO3↓+CO2↑+H2O;
(6)生成的MnCO3沉淀需经充分洗涤,若未洗涤干净,洗涤液中含有硫酸根离子,故检验洗涤液中是否含有硫酸根即可,方法为:取1~2mL最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净,
因此,本题正确答案是: :取1~2mL最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。


科目:高中化学 来源: 题型:
【题目】下列与阿伏加德罗常数的值( NA)有关的说法正确的是
A. 在标准状况下,2.24L水中含有氢原子的数目为2NA
B. 8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1NA
C. 在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后可得到NH3分子数为NA
D. 2.3 g Na与氧气完全反应,反应中转移的电子数在0.1NA~0.2NA之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素R的原子的质量数为70,其核内中子数为39,它的离子有28个电子,则此元素的氧化物的化学式应为
A. RO B. R2O3 C. RO2 D. R2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽,测得放出热量a kJ。又知12.0 g碳完全燃烧,放出热量为 b kJ。则热化学方程式C(s)+![]() O2(g)===CO(g) ΔH=Q 中Q等于( )
O2(g)===CO(g) ΔH=Q 中Q等于( )
A. -(a-b) kJ·mol-1 B. -(a+b) kJ·mol-1
C. -(5a-0.5b) kJ·mol-1 D. -(10a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是
A.Na2CO3用于制胃酸中和剂B.FeSO4用于制补铁剂
C.硬铝合金用于制造飞机和宇宙飞船D.14C用于测定文物年代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的铁和铜的混合物24g 与600mL稀硝酸恰好完全反应,生成NO 6.72L(标准状况),向反应后的溶液中加入1mol·L—1 NaOH溶液使金属离子恰好沉淀,过滤。下列有关说法错误的是( )
A. 混合物溶解后的溶液中c(Fe3+):c(Fe2+)=1:1 B. 稀硝酸的物质的量浓度是2 mol·L—1
C. 需加入NaOH溶液1000mL D. 最后所得沉淀在空气中充分加热可得固体32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废气中的SO2经如图中的两个循环可分别得到S和H2SO4。下列说法正确的是
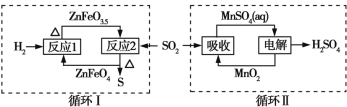
A. 循环Ⅰ中,反应1中的氧化产物为ZnFeO3.5
B. 循环Ⅰ中,反应2中的还原产物为ZnFeO4
C. Mn可作为循环Ⅱ中电解过程中的阳极材料
D. 循环Ⅰ和循环Ⅱ中消耗同质量的SO2,理论上得到S和H2SO4的质量之比为16∶49
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置示意图、实验现象及结论均正确的是
A | B | |
实验 |
|
|
现象 | 溴的四氯化碳溶液褪色 | 试管b中出现分层现象 |
结论 | 石蜡油分解产物中仅含有烯烃 | 反应生成难溶于饱和碳酸钠溶液的乙酸乙酯 |
C | D | |
实验 |
|
|
现象 | 试管中有淡黄色沉淀产生 | 反应过程中钠未熔化成小球 |
结论 | 非金属性Cl>S | 反应吸热 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照实验要求,用50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH 溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热。下列说法中正确的是

A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若烧杯上不盖硬纸板,测得的ΔH将偏小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com