
【题目】某同学按照实验要求,用50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH 溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热。下列说法中正确的是

A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若烧杯上不盖硬纸板,测得的ΔH将偏小
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下图所示:
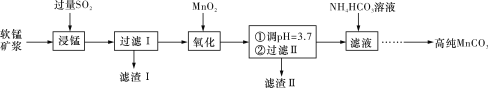
(1)“过滤Ⅰ”所得“滤渣Ⅰ”的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式______________________________________________________________。
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是____________________________________。
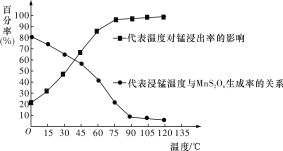
(4)向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是_________________________________________________________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________________________________________________________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1mol·L-1四氯金酸( HAuCl4)溶液中滴加0.1mol·L-1NaOH溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ)随pH变化关系如图2,则下列说法不正确的是
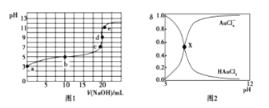
A. b点溶液中存在关系:2c(H+)+ c(HAuCl4)=2c(OH-)+ c(AuCl4-)
B. X点描述的是滴定曲线中b点含氯微粒的物质的量分数δ与pH的关系
C. c点溶液中存在关系:c(Na+)=c(AuCl4-)
D. d点时,溶液中微粒浓度的大小关系为c(Na+)>c(AuCl4-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池是一种常见化学电源,这种银锌电池的续航能力要比锂离子电池强,有望取代锂电池。其放电过程可表示为Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如下。下列说法不正确的是 ( )

A. 放电过程中, 化学能转化为电能
B. 放电过程中, 阳离子移向Ag2O 电极
C. Zn 电极的电极反应式:Zn-2eˉ+2OHˉ=Zn(OH)2
D. 放电过程中电解质溶液的碱性不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 氢氟酸、氯水、AgNO3 溶液保存在棕色玻璃瓶中
B. 镁条可以在二氧化碳气体中燃烧
C. 二氧化硫能漂白某些物质,加热后可恢复原色
D. 常温下铁片遇浓硫酸会发生钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,发生反应3A(g)+B(g)![]() 2Z(g),若最初A的物质的量浓度是2mol/L,测得10s内A的平均反应速率υ(A)=0.15mol/(Ls),则反应进行到10s时容器中A的物质的量浓度是
2Z(g),若最初A的物质的量浓度是2mol/L,测得10s内A的平均反应速率υ(A)=0.15mol/(Ls),则反应进行到10s时容器中A的物质的量浓度是
A. 3mol/L B. 1.2 mol/L C. 0.5mol/L D. 3.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对科学家的相关成果的说法正确的是( )
A. 屠呦呦发现抗疟新药青蒿素(C15H22O5),青蒿素属于烃类
B. 闵恩泽研发重油裂解的催化剂,催化裂解可以获得很多重要的化工原料
C. 凯库勒研究了苯环的结构,苯环是碳碳单键和碳碳双键交替的结构
D. 门捷列夫提出元素周期律,元素周期律指元素的性质随相对原子质量的递增而呈周期性的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:

(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂的量应为________________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_____________。
(3)试剂②选用________;写出其反应的离子方程式_______。
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com